题目内容
以焦炭为原料,制取乙二醇的过程如下:
(1)草酸二甲酯“催化还原”制乙二醇的反应原理如下:
CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g)
此反应的平衡常数表达式K= .
将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,可以发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到三组数据(见下表).
(2)实验1达平衡时,CO(g)的浓度为 mol/L.
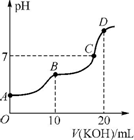
(3)实验3跟实验2相比,改变的条件可能是 (答出一种情况即可).草酸二甲酯的水解产物草酸(H2C2O4)为二元中强酸.常温下,向10mL 0.1mol/LH2C2O4溶液中逐滴加入0.1mol/L KOH溶液,所得滴定曲线如图.
(4)在草酸氢钾溶液中存在如下平衡:
H2O?H++OH-、HC2O4-?H++C2O42-和
(5)B点时,该溶液中H+、OH-、K+、HC2O4-的浓度大小关系为:
(6)若向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填序号)
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
(1)草酸二甲酯“催化还原”制乙二醇的反应原理如下:
CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g)
此反应的平衡常数表达式K=
将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,可以发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到三组数据(见下表).
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
(3)实验3跟实验2相比,改变的条件可能是

(4)在草酸氢钾溶液中存在如下平衡:
H2O?H++OH-、HC2O4-?H++C2O42-和
(5)B点时,该溶液中H+、OH-、K+、HC2O4-的浓度大小关系为:
(6)若向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
考点:化学平衡常数的含义,化学平衡建立的过程,化学平衡的影响因素,离子浓度大小的比较
专题:基本概念与基本理论
分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)结合化学方程式,平衡时CO2的物质的量,计算出CO转化的物质的量,得到平衡时CO的浓度;
(3)实验3跟实验2相比,平衡时CO2的物质的量不变,说明化学平衡状态等效,只是反应时间缩短,可以结合化学平衡移动知识获得答案;
(4)H2C2O4为二元中强酸,HC2O4-在溶液中既发生电离又发生水解;
(5)B点时,溶液为KHC2O4溶液,HC2O4-离子水解,生成OH-,显碱性,可比较离子浓度大小;
(6)a.根据物料守恒判断;
b.根据电荷守恒判断;
c.根据物料守恒、电荷守恒判断;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些.
(2)结合化学方程式,平衡时CO2的物质的量,计算出CO转化的物质的量,得到平衡时CO的浓度;
(3)实验3跟实验2相比,平衡时CO2的物质的量不变,说明化学平衡状态等效,只是反应时间缩短,可以结合化学平衡移动知识获得答案;
(4)H2C2O4为二元中强酸,HC2O4-在溶液中既发生电离又发生水解;
(5)B点时,溶液为KHC2O4溶液,HC2O4-离子水解,生成OH-,显碱性,可比较离子浓度大小;
(6)a.根据物料守恒判断;
b.根据电荷守恒判断;
c.根据物料守恒、电荷守恒判断;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些.
解答:
解:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学方程式为:CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g),K=
,
故答案为:K=
;
(2)平衡时CO2的物质的量为1.6mol,CO和CO2的计量数之比为1:1,则CO消耗了1.6mol,剩余4mol-1.6mol=2.4mol,浓度为
=1.2mol/L,
故答案为:1.2;
(3)实验3跟实验2相比,平衡时CO2的物质的量不变,需要时间少,化学反应速率快,不影响化学平衡,且能加快反应速率,可想到加入催化剂;又由于反应前后气体体积不变,也可以增大压强,故答案为:使用了催化剂或加大了压强;
(4)H2C2O4为二元中强酸,HC2O4-在溶液中发生电离与水解,还存在平衡:HC2O4-+H2O?H2C2O4+OH-,
故答案为:HC2O4-+H2O H2C2O4+OH-;
(5)B点时,溶液为KHC2O4溶液,HC2O4-离子水解,浓度减小,生成OH-,显碱性,OH-浓度大于H+,得到离子大小顺序为:c(K+)>c(HC2O4->c(H+)>c(OH-),故答案为:c(K+)>c(HC2O4->c(H+)>c(OH-);
(6)a.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故a正确;
b.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故b错误;
c.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,
c(Na+)=c(C2O42-)-c(H2C2O4),故c错误;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故d正确;
故答案为:ad.
| c(HOCH2-CH2OH)?c2(CH3OH) |
| c(CH3OOC-COOCH3)?c4(H2) |
故答案为:K=
| c(HOCH2-CH2OH)?c2(CH3OH) |
| c(CH3OOC-COOCH3)?c4(H2) |
(2)平衡时CO2的物质的量为1.6mol,CO和CO2的计量数之比为1:1,则CO消耗了1.6mol,剩余4mol-1.6mol=2.4mol,浓度为
| 2.4mol |
| 2L |
故答案为:1.2;
(3)实验3跟实验2相比,平衡时CO2的物质的量不变,需要时间少,化学反应速率快,不影响化学平衡,且能加快反应速率,可想到加入催化剂;又由于反应前后气体体积不变,也可以增大压强,故答案为:使用了催化剂或加大了压强;
(4)H2C2O4为二元中强酸,HC2O4-在溶液中发生电离与水解,还存在平衡:HC2O4-+H2O?H2C2O4+OH-,
故答案为:HC2O4-+H2O H2C2O4+OH-;
(5)B点时,溶液为KHC2O4溶液,HC2O4-离子水解,浓度减小,生成OH-,显碱性,OH-浓度大于H+,得到离子大小顺序为:c(K+)>c(HC2O4->c(H+)>c(OH-),故答案为:c(K+)>c(HC2O4->c(H+)>c(OH-);
(6)a.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故a正确;
b.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故b错误;
c.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,
c(Na+)=c(C2O42-)-c(H2C2O4),故c错误;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故d正确;
故答案为:ad.
点评:本题考查化学平衡常数、热化学方程式、化学平衡影响因素、离子浓度比较、原电池等,题目综合性较大,难度中等,(4)中离子浓度的比较中注意物料守恒、电荷守恒、质子恒等式等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列液体中pH>7的是( )
| A、人体血液 | B、蔗糖溶液 |
| C、可口可乐 | D、胃液 |
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | ||
B、Ca2++CO
| ||
C、CO
| ||
| D、H++OH-═H20 Cu(OH)2+H2SO4=CuSO4十2H20 |
 (1)①pH=a的CH3COOH溶液稀释100倍后所得溶液pH
(1)①pH=a的CH3COOH溶液稀释100倍后所得溶液pH 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究.回答下列问题: