题目内容
下列各项实验操作正确的是( )
| A、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B、为增强高锰酸钾溶液的氧化性,可用盐酸将高锰酸钾溶液酸化 |
| C、将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D、在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.水解后,应加酸至酸性,再加硝酸银检验溴离子;
B.盐酸与高锰酸钾发生反应;
C.苯与溴水不反应;
D.为了使反应完全,氢氧化钠溶液应过量.
B.盐酸与高锰酸钾发生反应;
C.苯与溴水不反应;
D.为了使反应完全,氢氧化钠溶液应过量.
解答:
解:A.水解后,应加酸至酸性,再加硝酸银检验溴离子,加热后,加入AgNO3溶液生成AgOH沉淀干扰检验,故A错误;
B.为提高高锰酸钾溶液的氧化能力,用硫酸将高锰酸钾溶液进行酸化,不能用盐酸酸化,二者可发生氧化还原反应而导致高锰酸钾变质,故B错误;
C.应该是将苯与液溴混合后加入铁粉,在加热制备溴苯,故C错误;
D.为了使反应完全,在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量,故D正确.
故选D.
B.为提高高锰酸钾溶液的氧化能力,用硫酸将高锰酸钾溶液进行酸化,不能用盐酸酸化,二者可发生氧化还原反应而导致高锰酸钾变质,故B错误;
C.应该是将苯与液溴混合后加入铁粉,在加热制备溴苯,故C错误;
D.为了使反应完全,在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量,故D正确.
故选D.
点评:本题考查化学实验方案的评价,这是实验均是学生比较熟悉的,常常是高考命题的热点,本题难度中等.

练习册系列答案
相关题目
 可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )
可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )| A、2SO3(g)?2SO2(g)+02(g) |
| B、H2(g)+I2(g)?2HI(g) |
| C、C(s)+H2O(g)?C0(g)+H2(g) |
| D、N2(g)+3H2(g)?2NH3(g) |
下列有关原子结构和元素周期律叙述中不正确的是( )
| A、第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 |
| B、同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |
| C、第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 |
| D、第ⅦA族元素是同周期中非金属性最强的元素 |
0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3mol Cu时,另一个电极上生成的气体在标准状况下的体积是( )
| A、5.6L |
| B、6.72L |
| C、1.344L |
| D、11.2L |
下列反应,①符合图象描述特点,②对其进行分析,结论是正确的.则合理选项为( )
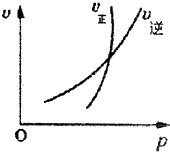

| A、2NO2(g)?N2O4(g);平衡后增大压强,气体颜色先变深后变浅 |
| B、N2(g)+3H2(g)?2NH3(g);将氨气液化分离后,有利于加快正反应速率 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g);加大氧气浓度,能提高氨气平衡转化率 |
| D、2HI(g)?H2(g)+I2(g);平衡后又充入一定量HI,再次平衡时HI的转化率不变 |
 (1)表中A的数值为
(1)表中A的数值为