题目内容
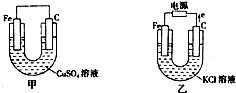 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:(1)甲池中碳棒的现象为:
(2)乙池中铁棒上发生的电极反应式
(3)若乙池的电源连接方向开始时就与如图的图示相反,则乙池中发生的总反应式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,甲为原电池,负极为Fe,电池反应为Fe+Cu2+═Fe2++Cu,乙为电解池,由电子流向正极可知,C为阳极,Fe为阴极,电解反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-,以此来解答.
| ||
解答:
解:(1)甲中发生Fe+Cu2+═Fe2++Cu,观察到铁棒逐渐溶解,碳棒上有红色物质析出,蓝色溶液逐渐变浅,负极电极方程式为Fe-2e-=Fe2+,
故答案为:碳棒上有红色物质析出;Fe-2e-=Fe2+;
(2)乙池铁棒为阴极,发生2H++2e-=H2↑,碳棒附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:2H++2e-=H2↑;5Cl2+I2+6H2O═2HIO3+10HCl;
(3)若乙池的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气,生成的亚铁离子与氢氧根离子反应生成氢氧化亚铁,观察到产生白色絮状沉淀,方程式为Fe+2H2O
Fe(OH)2+H2↑,
故答案为:Fe+2H2O
Fe(OH)2+H2↑.
故答案为:碳棒上有红色物质析出;Fe-2e-=Fe2+;
(2)乙池铁棒为阴极,发生2H++2e-=H2↑,碳棒附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:2H++2e-=H2↑;5Cl2+I2+6H2O═2HIO3+10HCl;
(3)若乙池的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气,生成的亚铁离子与氢氧根离子反应生成氢氧化亚铁,观察到产生白色絮状沉淀,方程式为Fe+2H2O
| ||
故答案为:Fe+2H2O
| ||
点评:本题考查原电池和电解池,装置的判断是解答的关键,注意把握原电池和电解池的工作原理,明确离子的放电顺序及发生的电极反应即可解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各离子组中,一定能大量共存的一组是( )
| A、pH=1的溶液中:Fe2+、Cl-、Na+、NO3- |
| B、由水电离出的c(H+)=1×10-13mol/L溶液中:Na+、CO32-、Cl-、K+ |
| C、pH=7的溶液中:NH4+、HCO3-、Mg2+、SO42- |
| D、无色溶液中:Al3+、HCO3-、I-、Ca2+ |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、二氧化硫的大量排放是造成光化学烟雾的主要原因 |
| B、使用清洁能源是防止酸雨发生的重要措施之一 |
| C、使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D、某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 |
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )| A、6种 | B、5种 | C、4种 | D、3种 |
0.1mol/L CH3COOH溶液中加水或加入少量CH3COONa晶体时,都会引起的变化的是( )
| A、溶液的pH增大 |
| B、CH3COOH的电离程度变大 |
| C、溶液的导电能力减弱 |
| D、溶液中c(OH-)减少 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,将0.2mol的NaCl和0.1molNaI溶于适量的水得到溶液,向其中加入0.08molAgNO3固体并充分反应,一段时间后将会( )
| A、只有AgCl沉淀 |
| B、只有AgI沉淀 |
| C、AgCl、AgI都沉淀都有 |
| D、没法确定是那种沉淀 |
光纤已经成为信息社会必不可少的高技术材料,制造光纤的主要原料是( )
| A、单质硅 | B、二氧化硅 |
| C、金属铜 | D、碳化硅 |
 (1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是
(1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是