题目内容
0.1mol/L CH3COOH溶液中加水或加入少量CH3COONa晶体时,都会引起的变化的是( )
| A、溶液的pH增大 |
| B、CH3COOH的电离程度变大 |
| C、溶液的导电能力减弱 |
| D、溶液中c(OH-)减少 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,溶液中c(H+)减小,c(OH-)增大,溶液的PH增大,导电能力减弱;
CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,c(H+)减小,c(OH-)增大,溶液的PH增大,导电能力增强.
CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,c(H+)减小,c(OH-)增大,溶液的PH增大,导电能力增强.
解答:
解:A、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,溶液中C(H+)减小,溶液的pH增大,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度也减小,c(H+)减小,溶液的pH增大,故A正确;
B、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,故B错误;
C、CH3COOH溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量CH3COONa晶体时,离子浓度增大,溶液的导电能力增强,故C错误;
D、CH3COOH溶液加水稀释,平衡向正反应方向移动,溶液中c(H+)减小,根据KW=c(H+)?c(OH-),c(OH-)增大,加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液中c(H+)减小,根据KW=c(H+)?c(OH-),c(OH-)增大,故D错误;
故选:A.
B、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,故B错误;
C、CH3COOH溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量CH3COONa晶体时,离子浓度增大,溶液的导电能力增强,故C错误;
D、CH3COOH溶液加水稀释,平衡向正反应方向移动,溶液中c(H+)减小,根据KW=c(H+)?c(OH-),c(OH-)增大,加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液中c(H+)减小,根据KW=c(H+)?c(OH-),c(OH-)增大,故D错误;
故选:A.
点评:本题考查外界条件对电离平衡的影响,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断.

练习册系列答案
相关题目
下列实验操作或装置符合实验要求的是( )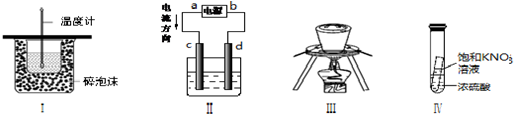

| A、装置Ⅰ可用于测定中和热 |
| B、装置Ⅱ中,c为阳极,d 为阴极 |
| C、装置Ⅲ可用于高温煅烧石灰石 |
| D、实验Ⅳ:静置一段时间,小试管内有晶体析出 |
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后( )
| A、溶液的pH变大 |
| B、c(Na+)与c(CO32-)的比值变大 |
| C、溶液浓度变大,有晶体析出 |
| D、实质是电解水,有晶体析出 |
下列实验过程中产生的现象与对应的图形正确的是( )
A、 氨气通入硫酸溶液中 |
B、 NaOH溶液中逐滴加入AlCl3溶液至过量 |
C、 向1L1.0mol?L-1的明矾溶液中加入Ba(OH)2溶液 |
D、 pH=2的盐酸和醋酸分别加水稀释 |
对含有酚酞的下列溶液操作后颜色变深的是( )
| A、AlCl3溶液中再溶入AlCl3 |
| B、CH3COONa稀溶液加热 |
| C、氨水中加入少量NH4Cl固体 |
| D、醋酸溶液加热 |
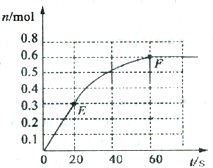 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示. 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后: 有两个密闭容器A和B,在相同温度下,A保持恒压,B保持恒容.起始时两容器的体积相等,向A、B中分别通入2molSO2和1molO2,使之发生反应:2SO2+O2?2SO3,并达到平衡.
有两个密闭容器A和B,在相同温度下,A保持恒压,B保持恒容.起始时两容器的体积相等,向A、B中分别通入2molSO2和1molO2,使之发生反应:2SO2+O2?2SO3,并达到平衡.