题目内容
在常温下,下列物种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4④0.1mol/LNH3.H2O和0.1mol/LNH4Cl⑤0.1mol/LNH3.H2O
(1)溶液①呈 性(填“酸”、“中”、“碱”),其原因是(用离子方程式表示)
(2)常温下,测得②的pH=7,则说明CH3COO-的水解程度 NH4+的水解程度 (填“>”“<”“=”,下同),CH3COO-与NH4+浓度的大小关系是c(CH3COO-) c(NH4+)
(3)在上述五种溶液中,pH最小的是 ;c(NH4+)最大的是 (填序号)
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4④0.1mol/LNH3.H2O和0.1mol/LNH4Cl⑤0.1mol/LNH3.H2O
(1)溶液①呈
(2)常温下,测得②的pH=7,则说明CH3COO-的水解程度
(3)在上述五种溶液中,pH最小的是
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:盐类的水解专题
分析:(1)铵根离子水解显示酸性;
(2)常温下,溶液的pH=7,显示中性,则氢离子和氢氧根浓度相等,根据电荷守恒确定离子浓度大小的关系;
(3)溶液酸性越强,氢离子浓度越大,pH越小,根据铵根离子的水解的影响情况确定铵根离子浓度大小.
(2)常温下,溶液的pH=7,显示中性,则氢离子和氢氧根浓度相等,根据电荷守恒确定离子浓度大小的关系;
(3)溶液酸性越强,氢离子浓度越大,pH越小,根据铵根离子的水解的影响情况确定铵根离子浓度大小.
解答:
解:(1)氯化铵为强酸弱碱盐,铵根离子水解,导致溶液显示酸性,即NH4++H2O?NH3.H2O+H+,故答案为:酸;NH4++H2O?NH3.H2O+H+;
(2)常温下,醋酸铵溶液中醋酸跟水解显示碱性,铵根离子水解显示酸性,溶液的pH=7,显示中性,则醋酸根离子和铵根离子水解程度相等,根据电荷守恒得c(CH3COO-)=c(NH4+),故答案为:=;=;
(3)①0.1mol/L NH4Cl中铵根离子浓度小于0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;
③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,小于0.1mol/L,溶液呈酸性;
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;
⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最大的是④;
故答案为:③;④.
(2)常温下,醋酸铵溶液中醋酸跟水解显示碱性,铵根离子水解显示酸性,溶液的pH=7,显示中性,则醋酸根离子和铵根离子水解程度相等,根据电荷守恒得c(CH3COO-)=c(NH4+),故答案为:=;=;
(3)①0.1mol/L NH4Cl中铵根离子浓度小于0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;
③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,小于0.1mol/L,溶液呈酸性;
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;
⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最大的是④;
故答案为:③;④.
点评:本题考查了盐类水解和弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,知道常见弱电解质、盐的性质是解本题关键,知道弱酸酸性强弱与酸根离子水解程度关系,注意硫酸氢铵电离方式,题目难度不大.

练习册系列答案
相关题目
将足量CO2通入下列各溶液中,所含离子或分子还能大量共存的一组微粒是( )
| A、K+、MnO4-、SO42-、H2SO3 |
| B、Na+、SiO32-、Cl-、NO3- |
| C、H+、Al3+、SO42-、NH4+ |
| D、Na+、S2-、H+、S2O32- |
下列推断正确的是( )
| A、金属单质与盐溶液的反应都是置换反应 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| D、C、N、S三种单质直接与O2反应都能生成两种以上氧化物 |
下列实验过程中产生的现象与对应的图形正确的是( )
A、 氨气通入硫酸溶液中 |
B、 NaOH溶液中逐滴加入AlCl3溶液至过量 |
C、 向1L1.0mol?L-1的明矾溶液中加入Ba(OH)2溶液 |
D、 pH=2的盐酸和醋酸分别加水稀释 |
普通硅酸盐水泥的主要成分有:①硅酸三钙 ②硅酸二钙 ③硅酸钠 ④铝酸三钙 ⑤二氧化硅( )
| A、①②④ | B、②④⑤ |
| C、③④⑤ | D、①③⑤ |
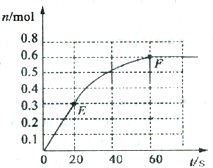 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示. 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后: