题目内容
7.在密闭容器中充入N2和H2,合成NH3,到2秒末测得,v (H2)═0.45mol/(L•s),则2秒末NH3的浓度为( )| A. | 0.5 mol/L | B. | 0.45 mol/L | C. | 0.6 mol/L | D. | 0.55 mol/L |
分析 v (H2)═0.45mol/(L•s),结合速率之比等于化学计量数之比计算v(NH3),结合v=$\frac{△c}{△t}$计算.
解答 解:发生N2+3H2=2NH3,v (H2)═0.45mol/(L•s),由速率之比等于化学计量数之比可知v(NH3)=0.45mol/(L•s)×$\frac{2}{3}$=0.3mol/(L•s),则2秒末NH3的浓度为0.3mol/(L•s)×2s=0.6mol/L,
故选C.
点评 本题考查化学反应速率,为高频考点,把握反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,注意氨气的浓度从0增大,题目难度不大.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
12.下列离子方程式正确的是( )
| A. | 铁和稀HNO3反应后的溶液pH=1:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢镁溶液中加入过量澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
19.下列化学方程式中,属于水解反应的是( )
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?H2CO3 | D. | HCO3-+H2O?CO32-+H3+O |
16.如表是元素周期表的一部分,回答下列问题
(1)表中元素②最简单氢化物的电子式为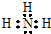 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
(2)工业生产单质④的原理是2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(4)0.2mol的单质⑥与100ml2mol•L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是1:1.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ||||
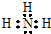 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.(2)工业生产单质④的原理是2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(4)0.2mol的单质⑥与100ml2mol•L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是1:1.
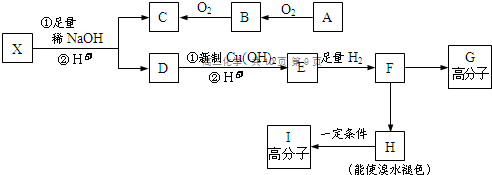
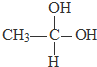 →CH3-CHO+H2O
→CH3-CHO+H2O ;
;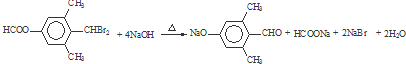 ;
;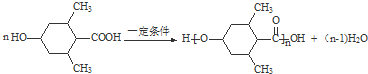 ;
;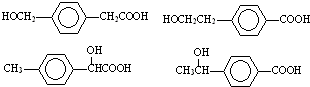 任意一种.
任意一种.



 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.