题目内容
20.各取1mol的下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③的顺序排列正确的是( )
| A. | 2 mol、2 mol、6 mol | B. | 5 mol、2 mol、6 mol | ||
| C. | 4 mol、2 mol、5 mol | D. | 3 mol、2 mol、6 mol |
分析 碳碳双键能和溴发生加成反应,且碳碳双键和溴的物质的量之比为1:1;苯环上酚羟基邻对位氢原子能和溴发生取代反应,且被取代氢原子与溴反应之比为1:1,据此分析解答.
解答 解:碳碳不饱和键键能和溴发生加成反应,苯环上酚羟基邻对位氢原子能被溴取代,
①中含有酚羟基,-C15H27中含有两个碳碳双键或一个碳碳三键,1mol该物质能和5mol溴反应;
②中含有酚羟基和碳碳双键,能和2mol溴反应;
③中含有酚羟基、碳碳双键,能和6mol溴反应,
通过以上分析知,各取1 mol下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③顺序分别是5mol、2mol、6mol,
故选B.
点评 本题考查有机物的结构和性质,侧重于考查学生化学知识的综合运用能力,为高考常见题型,题目难度中等,注意把握有机物的结构特点和官能团的性质,注意苯环上只有酚羟基邻对位氢原子才能和溴发生取代反应,为易错点.

练习册系列答案
相关题目
8.对发现元素周期律贡献最大的化学家是( )
| A. | 阿佛加德罗 | B. | 道尔顿 | C. | 牛顿 | D. | 门捷列夫 |
15.室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
5.下列关于胶体的叙述不正确的是( )
| A. | 将1mL饱和氯化铁溶液逐滴加入到20mL温水中,边加边搅拌 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
9.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2- | |
| C. | FeCl3溶液:K+、Na+、Fe2+、S2- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |

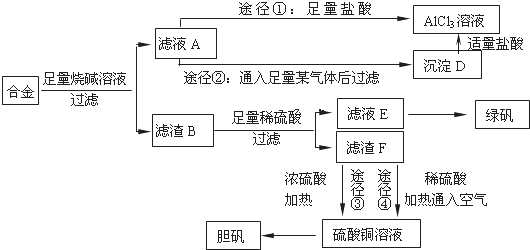
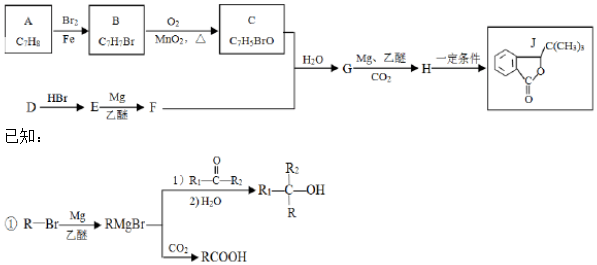
 .
. (写结构简式).
(写结构简式).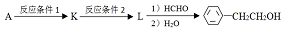
 .
.