题目内容
以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
| A、6mol | B、3mol |
| C、4mol | D、5mol |
考点:电解原理
专题:电化学专题
分析:活泼金属铁作电解池阳极时,阳极上阳极材料铁失电子发生氧化反应生成亚铁离子进入溶液,亚铁离子和溶液中的氢氧根离子生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,注意消耗的水有两部分:一部分被电解生成氢气,一部分和氢氧化亚铁反应生成氢氧化铁.
解答:
解:根据铁原子守恒知,2molFe(OH)3→2molFe(OH)2,所以生成2molFe(OH)3需要2molFe(OH)2;
活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O
H2+Fe(OH)2↓,
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.
故选D.
活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O
| ||
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.
故选D.
点评:本题考查了电解原理,难度不大,注意:活泼金属作电解池阳极时,活泼金属失电子发生氧化反应,而不是溶液中的阴离子失电子发生氧化反应.

练习册系列答案
相关题目
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是( )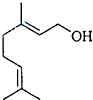

| A、香叶醇的分子式为C10H20O |
| B、不能使溴的四氯化碳溶液褪色 |
| C、不能发生催化氧化反应生成醛 |
| D、既能发生加成反应又能发生取代反应 |
热水瓶胆镀银常用的还原剂是( )
| A、福尔马林 | B、银氨溶液 |
| C、葡萄糖 | D、蔗糖 |
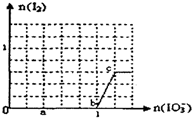 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO42- |
| B、a点时剩余NaHSO3的物质的量为1.8 mol |
| C、c点时的还原产物可能是KI或NaI |
| D、当溶液中I?与I2的物质的量之比为1:1时,加入的KIO3为1.2mol |


 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)═CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)═CH3OH(g)