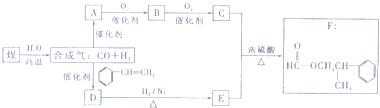
题目内容
下表是不同温度下水的离子积常数:
试回答以下问题:
(1)若25<t1<t2,则a 1×10-14(填“>”、“<”或“=”).
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)= .
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
考点:离子积常数
专题:
分析:(1)水的电离过程为吸热反应,温度升高,水的电离程度增大,水的离子积增大;
(2)硫酸钠溶液是显中性的.
(2)硫酸钠溶液是显中性的.
解答:
解:(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大,所以若25℃<t1<t2,则KW>1×10-14,
故答案为:>;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,故答案为:1000:1.
故答案为:>;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,故答案为:1000:1.
点评:本题考查了水的电离、溶液pH的简单计算,题目难度不大,本题是基础性知识的考查,主要是巩固学生对教材基础知识的理解掌握程度,提高学生的解题能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
| A、6mol | B、3mol |
| C、4mol | D、5mol |
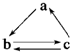 下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2═CH2 | CH3CH2OH | CH3CHO |
| A、A | B、B | C、C | D、D |
为了保护臭氧层,可采取的有效措施是( )
| A、减少二氧化硫的排放 |
| B、减少卤代烃的排放 |
| C、减少废气的含铅量 |
| D、减少二氧化碳的排放 |