题目内容
我国国标推荐的食品药品中Ca元素含量的测定方法之一为:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量.针对该实验中的滴定过程,回答以下问题:
(1)KMnO4溶液应该用 (填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有 .
(2)试写出滴定过程中发生反应的离子方程式: .
(3)滴定终点的颜色变化为:溶液由 色变为 色.
(4)以下哪些操作会导致测定的结果偏高 .
a.装入KMnO4溶液前未润洗滴定管
b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
(5)某同学对上述实验方法进行了改进并用于测定某品牌的钙片中的钙元素(主要为CaCO3)含量,其实验过程如下:取2.00g样品加入锥形瓶中,用酸式滴定管向锥形瓶内加入20.00mL浓度为0.10mol/L的盐酸(盐酸过量),充分反应一段时间,用酒精灯将锥形瓶内液体加热至沸腾,数分钟后,冷却至室温,加入2~3滴酸碱指示剂,用浓度为0.10mol/L的NaOH溶液滴定至终点,消耗NaOH溶液8.00mL.(提示:Ca(OH)2微溶于水,pH较低时不会沉淀出).据此回答:
①为使现象明显、结果准确,滴定过程中的酸碱指示剂应选择 试液 (填“石蕊”、“甲基橙”或“酚酞”);
②实验过程中将锥形瓶内液体煮沸的目的是 ;
③则此2.00g钙片中CaCO3的质量为 g.
(1)KMnO4溶液应该用
(2)试写出滴定过程中发生反应的离子方程式:
(3)滴定终点的颜色变化为:溶液由
(4)以下哪些操作会导致测定的结果偏高
a.装入KMnO4溶液前未润洗滴定管
b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
(5)某同学对上述实验方法进行了改进并用于测定某品牌的钙片中的钙元素(主要为CaCO3)含量,其实验过程如下:取2.00g样品加入锥形瓶中,用酸式滴定管向锥形瓶内加入20.00mL浓度为0.10mol/L的盐酸(盐酸过量),充分反应一段时间,用酒精灯将锥形瓶内液体加热至沸腾,数分钟后,冷却至室温,加入2~3滴酸碱指示剂,用浓度为0.10mol/L的NaOH溶液滴定至终点,消耗NaOH溶液8.00mL.(提示:Ca(OH)2微溶于水,pH较低时不会沉淀出).据此回答:
①为使现象明显、结果准确,滴定过程中的酸碱指示剂应选择
②实验过程中将锥形瓶内液体煮沸的目的是
③则此2.00g钙片中CaCO3的质量为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)高锰酸钾具有强氧化性,根据中和滴定所需仪器判断;
(2)在硫酸条件下,高锰酸钾将C2O42-氧化为CO2,自身被还原为MnSO4,据此写出反应的离子方程式;
(3)高锰酸钾溶液本身有颜色,为紫色,在开始滴入含C2O42-溶液中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色;
(4)分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,考虑二氧化碳溶于水,故要加热煮沸,过量盐酸用氢氧化钠滴定,考虑氢氧化钙的微溶性,应选择在pH较低时变色的指示剂,根据滴定算出过量盐酸,进而求得与碳酸钙反应的盐酸,根据方程式计算碳酸钙的质量.
(2)在硫酸条件下,高锰酸钾将C2O42-氧化为CO2,自身被还原为MnSO4,据此写出反应的离子方程式;
(3)高锰酸钾溶液本身有颜色,为紫色,在开始滴入含C2O42-溶液中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色;
(4)分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,考虑二氧化碳溶于水,故要加热煮沸,过量盐酸用氢氧化钠滴定,考虑氢氧化钙的微溶性,应选择在pH较低时变色的指示剂,根据滴定算出过量盐酸,进而求得与碳酸钙反应的盐酸,根据方程式计算碳酸钙的质量.
解答:
解:(1)高锰酸钾具有强氧化性,会腐蚀橡胶,应放在酸式滴定管中,中和滴定前需进行赶气泡、调零等操作,用烧杯盛液体,滴定中用锥形瓶盛待测液,用滴定管盛标准液,故所需玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶、烧杯,故答案为:酸式;锥形瓶、烧杯;
(2)高锰酸钾具有强氧化性,在硫酸条件下将C2O42-氧化为CO2,自身被还原为Mn2+,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(3)高锰酸钾溶液本身有颜色,为紫色,在开始滴入C2O42-中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:无;紫;
(4)a.滴定时,滴定管经水洗,蒸馏水洗后加入滴定剂高锰酸钾溶液,标准液体被稀释,浓度变稀,造成V(标准)偏大,由此计算结果偏大;
b.滴定前平视,滴定后俯视,则所用标准液读数偏小,由此计算结果偏小;
c.滴定结束后,滴定管尖端悬有一滴溶液,造成V(标准)偏大,由此计算结果偏大;
d.滴定过程中,振荡时将待测液洒出,所用标准液偏小,由此计算结果偏小;
故答案为:ac;
(5)①根据题给信息,Ca(OH)2微溶于水,pH较低时不会沉淀出,甲基橙变色范围为3.1~4.4,符合,石蕊变色不明显,酚酞变色范围为:8.2~10.0,pH较高,有氢氧化钙沉淀生成,干扰滴定,故用甲基橙作指示剂,故答案为:甲基橙;
②二氧化碳溶于水,加热煮沸赶走溶液中二氧化碳,避免二氧化碳和氢氧化钠反应造成误差,故答案为:将溶解在溶液中的CO2气体赶出;
③中和滴定消耗盐酸为:0.1mol/L×8mL=0.8mmol,和碳酸钙反应的盐酸为:0.1mol/L×20mL-0.8mmol=1.2mmol=0.0012mol,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 2mol
m 0.0012mol
m=
=0.06g,故答案为:0.06g.
(2)高锰酸钾具有强氧化性,在硫酸条件下将C2O42-氧化为CO2,自身被还原为Mn2+,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(3)高锰酸钾溶液本身有颜色,为紫色,在开始滴入C2O42-中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:无;紫;
(4)a.滴定时,滴定管经水洗,蒸馏水洗后加入滴定剂高锰酸钾溶液,标准液体被稀释,浓度变稀,造成V(标准)偏大,由此计算结果偏大;
b.滴定前平视,滴定后俯视,则所用标准液读数偏小,由此计算结果偏小;
c.滴定结束后,滴定管尖端悬有一滴溶液,造成V(标准)偏大,由此计算结果偏大;
d.滴定过程中,振荡时将待测液洒出,所用标准液偏小,由此计算结果偏小;
故答案为:ac;
(5)①根据题给信息,Ca(OH)2微溶于水,pH较低时不会沉淀出,甲基橙变色范围为3.1~4.4,符合,石蕊变色不明显,酚酞变色范围为:8.2~10.0,pH较高,有氢氧化钙沉淀生成,干扰滴定,故用甲基橙作指示剂,故答案为:甲基橙;
②二氧化碳溶于水,加热煮沸赶走溶液中二氧化碳,避免二氧化碳和氢氧化钠反应造成误差,故答案为:将溶解在溶液中的CO2气体赶出;
③中和滴定消耗盐酸为:0.1mol/L×8mL=0.8mmol,和碳酸钙反应的盐酸为:0.1mol/L×20mL-0.8mmol=1.2mmol=0.0012mol,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 2mol
m 0.0012mol
m=
| 100g×0.0012mol |
| 2mol |
点评:本题考查了滴定原理的应用,中等难度,注意题给信息的应用,根据滴定原理进行计算要明确反应原理.

练习册系列答案
相关题目
为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是( )
| A、加热,观察是否有气体放出 |
| B、溶于水后加石灰水,看有无沉淀 |
| C、溶于水后加MgCl2溶液,看有无沉淀 |
| D、加热后称量,看质量是否变化 |
下列关于常见有机化合物的说法中,正确的是( )
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、蔗糖和麦芽糖的水解产物都是葡萄糖 |
| C、石油经过分馏得到的各种产物是不同温度范围内的混合物 |
| D、苯和苯乙烯的最简式相同,是同系物 |
下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应;
②Fe与过量稀H2SO4反应后,再向其中加入KNO3;?
③Fe(NO3)2溶液中加入少量盐酸;?
④Fe和Fe2O3的混合物溶于盐酸中.
①过量的Fe与Cl2反应;
②Fe与过量稀H2SO4反应后,再向其中加入KNO3;?
③Fe(NO3)2溶液中加入少量盐酸;?
④Fe和Fe2O3的混合物溶于盐酸中.
| A、只有①?? |
| B、只有①②?? |
| C、只有①②③?? |
| D、全部 |
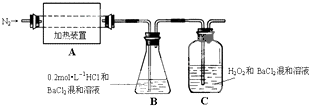 硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题: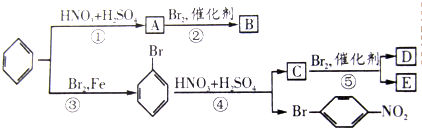


 问题讨论:
问题讨论:
 如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.