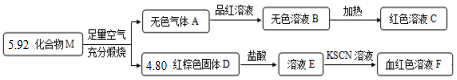
题目内容
10.25℃时,下列有关0.1mol•L-1醋酸溶液的说法中,正确的是( )| A. | pH=1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加入少量CH3COONa固体后,醋酸的电离程度减小 | |
| D. | 与0.1 mol•L-1NaOH溶液等体积混合后所得溶液显中性 |
分析 存在CH3COOH?H++CH3COO-,不能完全电离,加入少量CH3COONa固体后,电离平衡逆向移动,且与0.1 mol•L-1NaOH溶液等体积混合后恰好生成醋酸钠,以此来解答.
解答 解:A.醋酸为弱酸,电离出氢离子浓度小于0.1mol/L,则pH大于1,故A错误;
B.由醋酸电离及水的电离可知,c(H+)>c(CH3COO-),故B错误;
C.加入少量CH3COONa固体后,电离平衡逆向移动,醋酸的电离程度减小,故C正确;
D.与0.1 mol•L-1NaOH溶液等体积混合后恰好生成醋酸钠,水解显碱性,故D错误;
故选C.
点评 本题考查弱电解质的电离平衡,为高频考点,把握电离平衡移动、酸碱混合、盐类水解为解答本题的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
20.下列说法正确的是( )
| A. | 在水溶液中能电离出H+的化合物都是酸 | |
| B. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| C. | 金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物 | |
| D. | 酸碱盐都是电解质,其电离的过程属于化学变化 |
1.在过滤操作过程中,不需用到的玻璃仪器为( )
| A. | 漏斗 | B. | 烧杯 | C. | 玻璃棒 | D. | 酒精灯 |
15.侯氏制碱原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的是( )
| A. |  制取氨气 | B. |  制取NaHCO3 | C. | 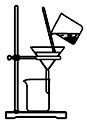 分离NaHCO3 | D. | 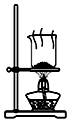 干燥NaHCO3 |
2.下列图示的实验设计能实现相应实验目的是( )
| A.验证FeCl3溶液中是否含有Fe2+ | B.检验溴乙烷消去的产物 |
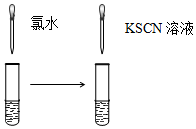 | 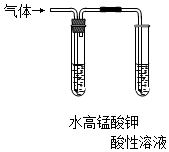 |
| C.检验氯气与亚硫酸钠是否发生反应 | D.对比Fe3+和Cu2+对H2O2分解的催化效果 |
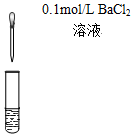 反应后混合液 | 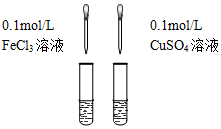 等体积5%的H2O2溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法或做法正确的是( )
| A. | 金属钠投入到硫酸铜的溶液中不能置换得到铜单质 | |
| B. | 金属钠着火燃烧时,可以用水灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 正常雨水PH等于7,酸雨的PH小于7 |


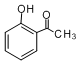 ;②
;②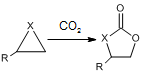 ( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH
( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH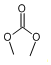 .
.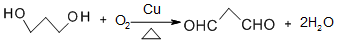 .
.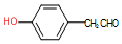 .
.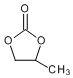 的合成路线.
的合成路线.