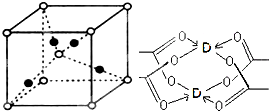
题目内容
某一反应体系中共有As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质.已知 As2S3是反应物之一,试写出并配平这个方程式: .
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:As2S3是反应物之一,根据元素守恒知,H2SO4、H3AsO4为生成物,As元素化合价由+3价变为+5价、S元素化合价由-2价变为+6价,所以As2S3是还原剂,还需要氧化剂才能实现该反应,硝酸具有氧化性,所以硝酸是反应物,则NO是产物,根据转移电子相等、原子守恒配平方程式.
解答:
解:As2S3是反应物之一,根据元素守恒知,H2SO4、H3AsO4为生成物,As元素化合价由+3价变为+5价、S元素化合价由-2价变为+6价,所以As2S3是还原剂,还需要氧化剂才能实现该反应,硝酸具有氧化性,所以硝酸是反应物,则NO是产物,根据元素守恒知,反应物中有水参加,转移电子总数是8,4,所以As2S3的计量数是3、HNO3的计量数是28,再结合原子守恒配平方程式为3As2S3+28HNO3+4H2O=9H2SO4+28NO+6H3AsO4,故答案为:3As2S3+28HNO3+4H2O=9H2SO4+28NO+6H3AsO4.
点评:本题考查氧化还原反应方程式的配平,正确确定反应物是解本题关键,根据氧化性强弱判断氧化剂、氧化产物,注意硫元素化合价变化,知道常见元素化合价,灵活运用原子守恒、转移电子守恒配平方程式,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
NaNO2是一种食品添加剂,它能致癌,酸性KMnO4溶液与NaNO2反应的离子方程式为MnO4-+NO2-+H+-Mn2++□+H2O (未配平).下列叙述正确的是( )
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
下列各原子轨道中能容纳电子数最多的是( )
| A、5p | B、6s | C、4f | D、4d |
下列说法正确的是( )
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
P轨道电子云形状正确的是( )
| A、球形对称 |
| B、对顶对称 |
| C、极大值在x、y、z轴上的纺锤形 |
| D、互相垂直的花瓣形 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b<80y(1-
|
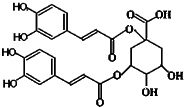 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )| A、分子中含有6个手性碳原子 |
| B、一定条件下能发生酯化反应和消去反应 |
| C、不能与氯化铁溶液发生显色反应 |
| D、1 mol洋蓟素最多可与11 mol NaOH反应 |