题目内容
17.下列有关溶液中粒子浓度的关系式中,正确的是( )| A. | pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 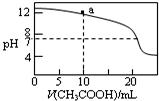 图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
分析 A.醋酸根离子水解程度小于碳酸氢根离子水解程度,溶液PH相同则CH3COONa溶液浓度大于NaHCO3溶液;
B.0.1mol•L-1某二元弱酸强碱盐NaHA溶液存在物料守恒,n(Na)=n(A),钠离子和所有A元素形成的存在形式总和相同;
C.图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时依据溶液中电荷守恒分析判断;
D.上图a点溶液为醋酸钠和氢氧化钠的混合溶液中依据物料守恒和电荷守恒计算分析判断.
解答 解:A.醋酸根离子水解程度小于碳酸氢根离子水解程度,溶液PH相同则CH3COONa溶液浓度大于NaHCO3溶液,两种溶液中的c(Na+):②<①,故A错误;
B.0.1mol•L-1某二元弱酸强碱盐NaHA溶液存在物料守恒,n(Na)=n(A),钠离子和所有A元素形成的存在形式总和相同,c(Na+)=c(A2-)+c(HA-)+c(H2A),故B错误;
C.图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时依据溶液中电荷守恒分析,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(OH-)=c(H+),c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C错误;
D.上图a点溶液为醋酸钠和氢氧化钠的混合溶液中依据物料守恒和电荷守恒计算分析,根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),c(Na+)+c(H+)=c(CH3COO-)+c(OH-),代入计算得到c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较,电解质溶液中电荷守恒、物料守恒等知识点的分析应用,掌握基础是解题关键,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NO | 水 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)═c(Na+)+c(H+) | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
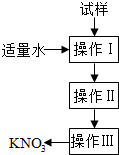
| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩.趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共需两次过滤 |
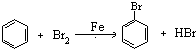 (或
(或 ).
).
 .
. 3,4-二甲基辛烷.
3,4-二甲基辛烷. 2,3,4-三甲基己烷.
2,3,4-三甲基己烷.