题目内容
下列说法正确的是( )
A、 实验室制备硝基苯的装置 |
B、 振荡后下层为无色 |
C、 可以达到石油分馏的目的 |
D、 可以达到验证溴乙烷发生消去反应生成烯烃的目的 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.苯和硝酸易挥发,应在密闭容器中反应;
B.氢氧化钠可与溴反应;
C.温度计应与蒸馏烧瓶支管口处相平;
D.乙醇易挥发,可与高锰酸钾发生氧化还原反应.
B.氢氧化钠可与溴反应;
C.温度计应与蒸馏烧瓶支管口处相平;
D.乙醇易挥发,可与高锰酸钾发生氧化还原反应.
解答:
解:A.苯和硝酸易挥发,应在密闭容器中反应,该装置不能用于制备硝基苯,故A错误;
B.氢氧化钠可与溴反应,且四氯化碳密度比水大,可观察到振荡后下层为无色的现象,故B正确;
C.温度计应与蒸馏烧瓶支管口处相平,测量的是蒸气的温度,故C错误;
D.乙醇易挥发,可与高锰酸钾发生氧化还原反应,应排除乙醇的干扰,故D错误.
故选B.
B.氢氧化钠可与溴反应,且四氯化碳密度比水大,可观察到振荡后下层为无色的现象,故B正确;
C.温度计应与蒸馏烧瓶支管口处相平,测量的是蒸气的温度,故C错误;
D.乙醇易挥发,可与高锰酸钾发生氧化还原反应,应排除乙醇的干扰,故D错误.
故选B.
点评:本题考查较为综合,涉及硝基苯的制取、分液、蒸馏以及乙烯的制取等实验操作,综合考查学生的实验能力和化学知识的运用能力,为高考常见题型,题目难度中等.

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是( )
| A、生成物总能量一定低于反应物总能量 |
| B、等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
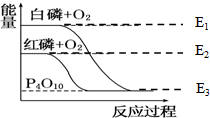 白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )| A、白磷比红磷稳定 |
| B、红磷转变为白磷是吸热反应 |
| C、白磷燃烧是吸热反应 |
| D、红磷燃烧的热化学方程式可表达为:4P(s)+5O2(g)=P4O10(s),△H=-(E3-E2) kJ/mol |
已知一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量.在同温同压下向密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入2molN2和3molH2,相同温度下达到平衡时放出热量为Q2kJ.则下列叙述正确的是( )
| A、2Q2>Q1=92.4kJ |
| B、2Q2=Q1=92.4kJ |
| C、Q1<Q2<92.4kJ |
| D、2Q2=Q1<92.4kJ |
有机物分子中原子或原子团间的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| B、乙醇与金属钠反应没有水与金属钠反应剧烈 |
| C、甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 |
| D、苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
下列有关实验操作的叙述正确的是( )
| A、为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、用托盘天平称取1.06 g无水碳酸钠,溶于250 mL水,配制0.04 mol?L-1 Na2CO3溶液 |
| D、为减小误差,配制溶液时容量瓶必须洗净并烘干后才能使用 |
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )


| A、1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH |
| B、1molX最多能与9mol氢气反应 |
C、X能与糠醛( )发生缩聚反应 )发生缩聚反应 |
| D、1molX与足量的浓溴水反应,最多消耗4molBr2 |
下列关于有机化合物的认识正确的是( )
| A、蛋白质在空气中完全燃烧转化为水和二氧化碳 |
| B、淀粉与纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 |
| C、乙烯均可使溴水和高锰酸钾溶液褪色,是因为都发生了加成反应 |
| D、在浓硫酸存在下,乙酸与乙醇共热生成乙酸乙酯的反应为取代反应 |