题目内容
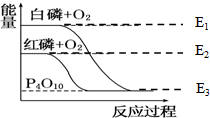 白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )| A、白磷比红磷稳定 |
| B、红磷转变为白磷是吸热反应 |
| C、白磷燃烧是吸热反应 |
| D、红磷燃烧的热化学方程式可表达为:4P(s)+5O2(g)=P4O10(s),△H=-(E3-E2) kJ/mol |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、物质能量越高越活泼;
B、依据能量守恒分析判断;
C、白磷燃烧是放热反应;
D、红磷燃烧是放热反应.
B、依据能量守恒分析判断;
C、白磷燃烧是放热反应;
D、红磷燃烧是放热反应.
解答:
解:A、依据图象分析,白磷能量高于红磷,所以红磷稳定,故A错误;
B、依据图象分析,白磷能量高于红磷,依据能量守恒,红磷转变为白磷是吸热反应,故B正确;
C、图象分析可知,白磷燃烧是放热反应,故C错误;
D、依据图象分析,红磷燃烧是放热反应,反应的热化学方程式:4P(s)+5O2(g)→P4O10(s),△H=-(E2-E3) kJ/mol,故D错误;
故选B.
B、依据图象分析,白磷能量高于红磷,依据能量守恒,红磷转变为白磷是吸热反应,故B正确;
C、图象分析可知,白磷燃烧是放热反应,故C错误;
D、依据图象分析,红磷燃烧是放热反应,反应的热化学方程式:4P(s)+5O2(g)→P4O10(s),△H=-(E2-E3) kJ/mol,故D错误;
故选B.
点评:本题考查了反应焓变与物质能量的关系分析,图象分析判断是解题关键,题目难度中等.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
已知H-H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2(g)+
O2(g)═H2O(l)△H=-286kJ/mol,判断H2O分子中O-H键的键能为( )
| 1 |
| 2 |
| A、485.5 kJ/mol |
| B、610 kJ/mol |
| C、917 kJ/mol |
| D、1 220 kJ/mol |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol硫酸钾中阴离子所带电荷数为NA |
| B、常温下,2.7克铝与足量的稀硫酸反应,失去的电子数为0.1NA |
| C、在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+ 数等于NA |
| D、在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
为配制NH4+的浓度与Cl-的浓度之比接近1:1的溶液,可在NH4Cl溶液中加入下列的( )
| A、适量的稀硫酸 |
| B、适量的NaCl溶液 |
| C、适量的氨水 |
| D、适量的NaOH溶液 |
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶性的甲基磺酸铅为电解质,电池总反应为:Pb+PbO2+4H+
2Pb2++2H2O.下列有关新型液流式铅酸蓄电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应式为Pb-2e-+SO42-=PbSO4 |
| B、充放电时,溶液的导电能力变化不大 |
| C、以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D、充电时的阳极反应式为Pb 2++2e-+4OH-=PbO2+2H2O |
用惰性电极电解足量的下列电解质溶液,一段时间后,两极上均有无色气体产生的是( )
| A、NaCl |
| B、CuSO4 |
| C、Na2SO4 |
| D、HCl |
下列说法正确的是( )
A、 实验室制备硝基苯的装置 |
B、 振荡后下层为无色 |
C、 可以达到石油分馏的目的 |
D、 可以达到验证溴乙烷发生消去反应生成烯烃的目的 |
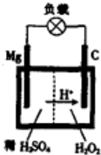 1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.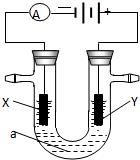 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: