题目内容
取一小块钠在空气中加热片刻后与一定量的水反应,收集到168mL气体(标准状况),向所得溶液中滴入1.00mol?L-1的盐酸溶液30.00mL恰好中和完全,将产生的气体在适当条件下点燃,恰好完全反应.求钠块在空气中加热片刻后所得到的固体成分及其分别的质量:
考点:钠的化学性质
专题:金属概论与碱元素
分析:钠在空气中加热反应生成过氧化钠、氧化钠,过氧化钠与水反应生成氧气,钠与水反应生成氢氧化钠和氢气,依据盐酸与氢氧化钠反应结合钠原子个数守恒计算生成氢氧化钠的物质的量,依据产生氢气与氧气在适当条件下点燃,恰好完全反应,结合方程式计算钠和过氧化钠的质量.
解答:
解:设钠物质的量为xmol,过氧化钠的物质的量为ymol,氧化钠的质量为z;
收集到气体体积n=
=0.0075mol;消耗盐酸的物质的量n=1.00mol?L-1×0.03L=0.03mol,
钠与水反应方程式:2Na+2H2O=2NaOH+H2↑;
2 2 1
x x 0.5x
过氧化钠与水反应的方程式为:2Na2O2 +2H2O═4NaOH+O2↑,
2 4 1
y 2y 0.5y 由题意知:0.5x+0.5y=0.0075mol;
氧化钠与水反应:Na2O+H2O=2NaOH
1 2
z 2z
氢氧化钠与盐酸反应方程式:NaOH+HCl=NaCl+H2O
1 1
x+2y x+2y+2z 由题意知:x+2y+2z=0.03mol;
氢气与氧气反应的方程式:2H2+O2=2H2O;
2 1
0.5x 0.5y 由题意可知:0.5x:0.5y=2:1;
0.5x+0.5y=0.0075mol;
x+2y+2z=0.03mol;
0.5x:0.5y=2:1;
解得x=0.01mol,y=0.005mol,z=0.05mol;
则钠的质量=0.01mol×23g/mol=0.23g;
过氧化钠的质量=0.005mol×78g/mol=0.39g;
氧化钠的质量=0.005mol×62g/mol=0.31g;
答:钠块在空气中加热片刻后所得到的固体成分及其分别的质量为钠0.23g、过氧化钠0.39g、氧化钠0.31g.
收集到气体体积n=
| 0.168L |
| 22.4L/mol |
钠与水反应方程式:2Na+2H2O=2NaOH+H2↑;
2 2 1
x x 0.5x
过氧化钠与水反应的方程式为:2Na2O2 +2H2O═4NaOH+O2↑,
2 4 1
y 2y 0.5y 由题意知:0.5x+0.5y=0.0075mol;
氧化钠与水反应:Na2O+H2O=2NaOH
1 2
z 2z
氢氧化钠与盐酸反应方程式:NaOH+HCl=NaCl+H2O
1 1
x+2y x+2y+2z 由题意知:x+2y+2z=0.03mol;
氢气与氧气反应的方程式:2H2+O2=2H2O;
2 1
0.5x 0.5y 由题意可知:0.5x:0.5y=2:1;
0.5x+0.5y=0.0075mol;
x+2y+2z=0.03mol;
0.5x:0.5y=2:1;
解得x=0.01mol,y=0.005mol,z=0.05mol;
则钠的质量=0.01mol×23g/mol=0.23g;
过氧化钠的质量=0.005mol×78g/mol=0.39g;
氧化钠的质量=0.005mol×62g/mol=0.31g;
答:钠块在空气中加热片刻后所得到的固体成分及其分别的质量为钠0.23g、过氧化钠0.39g、氧化钠0.31g.
点评:本题考查了有关方程式的计算,题目难度不大,熟悉钠及其氧化物的性质是解题关键.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
下列说法正确的是( )
A、 实验室制备硝基苯的装置 |
B、 振荡后下层为无色 |
C、 可以达到石油分馏的目的 |
D、 可以达到验证溴乙烷发生消去反应生成烯烃的目的 |
下列关于强弱电解质的说法中,正确的是( )
| A、MgO在熔化状态下全部电离,是弱电解质 |
| B、具有极性键的共价化合物都是强电解质 |
| C、具有非极性键的共价化合物都是弱电解质 |
| D、所有弱酸、弱碱都是弱电解质 |
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应:2Mn2++5S2O82-+8X=2MnO42-+10SO42-+16H+,下列说法正确的是( )
| A、X是H2O |
| B、还原性:SO42->Mn2+ |
| C、该反应中酸性介质可以为盐酸 |
| D、每生成0.1molSO42-,转移电子0.05mol |
到高中我们将从元素原子得失电子的角度来认识氧化还原反应,而元素原子得失电子表现为元素化合价的变化.因此可以把元素化合价有升降的化学反应确定为氧化还原反应,据此可判断下列化学反应一定不属于氧化还原反应的是( )
| A、置换反应 | B、化合反应 |
| C、复分解反应 | D、分解反应 |
根据下列金属的熔沸点其中不能形成合金的是( )
| 金属 | Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
| A、Cu与Al |
| B、Fe与Cu |
| C、Fe与Na |
| D、Al与Na |
下列各溶液中一定能大量共存的离子组是( )
| A、加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、常温下,c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |
| D、常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+ |
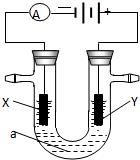 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: