题目内容
16.不能用勒夏特列原理解释的是( )| A. | 使用铁触媒,加快合成氨反应速率 | |
| B. | 乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 | |
| C. | 打开汽水瓶盖,即有大量气泡逸出 | |
| D. | 配置FeCl3溶液时,加入少量盐酸 |
分析 勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A、使用催化剂平衡不移动,所以不能用勒夏特列原理解释,故A选;
B、乙酸乙酯在碱性条件下,氢离子浓度变小,平衡正向,促进水解,而在酸性条件下氢离子浓度变大抑制水,能用勒夏特利原理解释,故B不选;
C、因溶液中存在二氧化碳的溶解平衡,打开汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故C不选;
D、配置FeCl3溶液时中铁离子的水解呈酸性,加入少量盐酸,抑制水解使平衡逆向移动,故D不选;
故选A.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.由苯乙烯和乙醇制备苯乙酸乙酯的过程中发生的反应类型不包括( )
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 还原反应 |
7.下列实验事实可用来证明氨水是弱碱的是( )
| A. | 氨水能跟氯化铝溶液反应生成氢氧化铝沉淀 | |
| B. | 铵盐受热易分解 | |
| C. | 1mol/L 的氨水可以使酚酞试液变红 | |
| D. | 常温下0.1mol/L的氯化铵溶液的pH为5 |
4.元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是( )
| 元素 | X | Y | Z |
| 最高、最低化合价 | +7 -1 | +6 -2 | +5 -3 |
| A. | 原子序数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 稳定性:HX>H2Y>ZH3 | D. | 酸性由强到弱:HXO4>H2YO4>H3ZO4 |
1.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )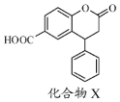

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1 mol化合物X最多能与2 molNaOH反应 | |
| D. | 在酸性条件下水解,水解产物只有一种 |
8.化学式能表示物质分子组成的是( )
| A. | C6H6 | B. | SiO2 | C. | NaOH | D. | NH4Cl |
6.宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器.研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义.下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是( )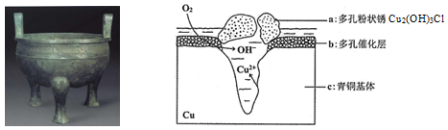

| A. | 青铜器发生电化学腐蚀,图中c作负极,被氧化 | |
| B. | 正极发生的电极反应为O2+4e-+2H2O=4OH- | |
| C. | 环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| D. | 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L |
