题目内容
7.X是核外电子数最少的元素,Y是地壳中含量最多的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的原子晶体.下列叙述错误的是( )| A. | WX4是一种重要的清洁能源 | |
| B. | 固态X2Y是分子晶体 | |
| C. | ZW是原子晶体,可用作耐磨材料 | |
| D. | ZY2的晶体中每个Z原子与两个Y原子成键 |
分析 X是核外电子数最少的元素,则X为H;Y是地壳中含量最多的元素,则Y为O;Z在地壳中的含量仅次于Y,则Z为Si;W可以形成自然界最硬的原子晶体,W为C,其单质金刚石为原子晶体,以此进行解答.
解答 解:X是核外电子数最少的元素,则X为H;Y是地壳中含量最多的元素,则Y为O;Z在地壳中的含量仅次于Y,则Z为Si;W可以形成自然界最硬的原子晶体,W为C,其单质金刚石为原子晶体.
A.WX4是CH4,是一种重要的清洁能源,故A正确;
B.固态X2Y是H2O,构成微粒为分子,属于分子晶体,故B正确;
C.ZW是SiC,构成微粒为原子,是由共价键形成的空间网状结构的原子晶体,可用作耐磨材料,故C正确;
D.ZY2为SiO2,晶体中每个Si原子与4个O原子形成4个Si-O键,故D错误.
故选D.
点评 本题考查结构与位置关系、晶体类型及性质是等,熟悉物质的结构和性质即可解答,注意中学常见的原子晶体,题目难度不大.

练习册系列答案
相关题目
17.实验室制氯气时有如下操作,操作顺序正确的是( )
①连好装置,检查气密性;
②缓缓加热;
③加入二氧化锰粉末;
④从装有浓盐酸的分液漏斗中放出浓盐酸;
⑤将多余的氯气用氢氧化钠溶液吸收;
⑥向上排放收集氯气.
①连好装置,检查气密性;
②缓缓加热;
③加入二氧化锰粉末;
④从装有浓盐酸的分液漏斗中放出浓盐酸;
⑤将多余的氯气用氢氧化钠溶液吸收;
⑥向上排放收集氯气.
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①④③②⑥⑤ | D. | ①③④②⑥⑤ |
18.下列化合物的核磁共振氢谱中出现峰个数最多的是( )
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,3,4-四甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
15.下列化合物中含有手性碳原子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
2.在120℃、101kPa时,将1L丁烷和若干升O2混合,点燃使之充分反应.反应后,恢复到原温度和原压强,测得的气体体积为mL,若通过足量碱石灰,气体体积变为nL.若m-n=8,则反应消耗掉的O2体积是(同温同压)( )
| A. | 5L | B. | 5.5L | C. | 6L | D. | 6.5L |
16.下列有关说法正确的是( )
| A. | 氨水稀释后,溶液中 的值减小 的值减小 | |
| B. | 0.1mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质最的减少与阴极质量的增加一定相等 | |
| D. | 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
17.部分弱电解质的电离平衡常数如下表,下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 25℃时,若将pH=3的盐酸与pH=11的氨水混合后溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 结合H+的能力:CO32->HCO3->CN->HCOO- | |
| D. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
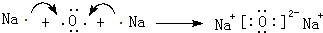 、
、 .
.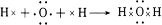 、
、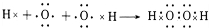 .
.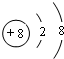 .
. 和XY2
和XY2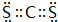 .
.