题目内容
19.W、X、Y和Z都是周期表中前20号元素,已知:①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④X是周期表中能形成的化合物种类最多的元素;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物.请用化学用语回答:
(1)Y元素在周期表中的位置是第三周期第VIA族; Z元素的离子结构示意图是
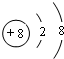 .
.(2)Y和Z形成的两种常见化合物的分子式是SO2和SO2、SO3.
(3)写出下列化合物的电子式WZ
 和XY2
和XY2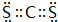 .
.(4)比较Y、Z气态氢化物的稳定性H2O>H2S(用分子式表示)
(5)W、Y、Z三种元素简单离子的离子半径由大到小的顺序是:S2->Ca2->O2-.
分析 W、X、Y和Z都是周期表中前20号元素,由④中X是周期表中能形成的化合物种类最多的元素,则X为C元素,由③中X和Z属同一周期元素,它们能形成两种气态化合物,由②中Y和Z属同族元素,它们能形成两种常见化合物,可推知Z为O元素,Y为S元素,⑤中C元素与S元素可以CS2.由①中W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物,则W为Ca,化合物WY为CaS,据此解答.
解答 解W、X、Y和Z都是周期表中前20号元素,由④中X是周期表中能形成的化合物种类最多的元素,则X为C元素,由③中X和Z属同一周期元素,它们能形成两种气态化合物,由②中Y和Z属同族元素,它们能形成两种常见化合物,可推知Z为O元素,Y为S元素,⑤中C元素与S元素可以CS2.由①中W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物,则W为Ca,化合物WY为CaS.
(1)Y为S元素,元素在元素周期表中的位置为:第三周期第VIA族,Z元素的离子为O2-,离子结构示意图是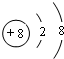 ,
,
故答案为:第三周期第VIA族;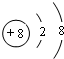 ;
;
(2)Y和Z形成的两种常见化合物的分子式是SO2、SO3,
故答案为:SO2、SO3;
(3)CaO的电子式为 ,CS2的电子式为:
,CS2的电子式为: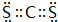 ,
,
故答案为: ;
;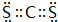 ;
;
(4)非金属性O>S,故氢化物稳定性H2O>H2S,
故答案为:H2O>H2S;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Ca2->O2-,
故答案为:S2->Ca2->O2-.
点评 本题考查位置结构性质关系的综合应用,难度中等,关键是正确推断元素,需要学生熟练掌握元素化合物知识.

练习册系列答案
相关题目
9.下列推断正确的是( )
| A. | 等质量的NaHCO3和Na2CO3固体中,分别加入足量盐酸,NaHCO3产生的 气体多 | |
| B. | 过量的铁与硝酸反应生成硝酸亚铁,过量的铁与氯气反应也生成氯化亚铁 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水现酸性,向其中滴加几滴紫色石蕊试液,充分振荡后,溶液最终呈红色 |
10.下列各项比较错误的是( )
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Ge(OH)4>Sn(OH)4>Pb(OH)4 |
7.X是核外电子数最少的元素,Y是地壳中含量最多的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的原子晶体.下列叙述错误的是( )
| A. | WX4是一种重要的清洁能源 | |
| B. | 固态X2Y是分子晶体 | |
| C. | ZW是原子晶体,可用作耐磨材料 | |
| D. | ZY2的晶体中每个Z原子与两个Y原子成键 |
4.近日,化妆品品牌法兰琳卡因在CCTV8一段仅15秒的广告被舆论讨伐,这段广告中著名歌手梁静茹连喊三次“我们恨化学”这句话,甚至直接用这五个大字占满屏幕,其目的是宣传产品的“纯天然”性.下列有关说法错误的是( )
| A. | 绿色化学的核心是应用化学原理治理环境污染 | |
| B. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| C. | 化妆品中的“天然植物精华”在提取过程中可能用到化学中的萃取、蒸馏技术 | |
| D. | 苯是重要化工原料,被英国科学家法拉第首先发现,以煤和石油为原料通过化学变化均可得到苯 |
9.下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是( )
| A. | Fe与稀HNO3 | B. | Na2O2与CO2 | ||
| C. | NaOH溶液与CO2 | D. | AlCl3溶液与NaOH溶液 |