题目内容
16.下列有关说法正确的是( )| A. | 氨水稀释后,溶液中 的值减小 的值减小 | |
| B. | 0.1mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质最的减少与阴极质量的增加一定相等 | |
| D. | 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
分析 A.氨水稀释电离平衡正向移动,NH3•H2O的物质的量减少,NH4+物质的量增大,浓度比等于物质的量比,则该比值增大;
B.加水稀释碳酸根离子的水解程度增大,但氢氧根离子浓度减小;
C.根据阳极粗铜中含有铁、锌、金、铂等金属分析;
D.该反应△S<0,结合能自发进行的反应符合△H-T△S<0分析.
解答 解:A.氨水稀释后期电离平衡正向移动,NH3•H2O的物质的量减少,NH4+物质的量增大,由于在同一溶液中,二者的浓度比等于物质的量比,所以该比值增大,故A错误;
B.0.1mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,但是氢氧根离子浓度减小,溶液的pH减小,故B正确;
C.阳极粗铜中含有铁、锌、金、铂等金属,则电解过程中阳极质量减少与阴极质量增加不一定相同,故C错误;
D.该反应的△S<0,反应能自发进行,△H-T△S<0,则该反应的△H<0,故D正确;
故选BD.
点评 本题考查了盐的水解原理及其影响、粗铜冶炼、反应自发进行判断等知识,题目难度中等,明确盐的水解原理为解答关键,注意掌握判断反应能否自发进行的方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.在一定条件下,将m体积NO和n体积O2同时倒立于水中且盛满水的容器,充分反应后,容器内残留0.5m 体积的气体,该气体与空气接触后变为红棕色.则m与n的比值为( )
| A. | 3:2 | B. | 2:3 | C. | 8:3 | D. | 3:8 |
7.X是核外电子数最少的元素,Y是地壳中含量最多的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的原子晶体.下列叙述错误的是( )
| A. | WX4是一种重要的清洁能源 | |
| B. | 固态X2Y是分子晶体 | |
| C. | ZW是原子晶体,可用作耐磨材料 | |
| D. | ZY2的晶体中每个Z原子与两个Y原子成键 |
4.近日,化妆品品牌法兰琳卡因在CCTV8一段仅15秒的广告被舆论讨伐,这段广告中著名歌手梁静茹连喊三次“我们恨化学”这句话,甚至直接用这五个大字占满屏幕,其目的是宣传产品的“纯天然”性.下列有关说法错误的是( )
| A. | 绿色化学的核心是应用化学原理治理环境污染 | |
| B. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| C. | 化妆品中的“天然植物精华”在提取过程中可能用到化学中的萃取、蒸馏技术 | |
| D. | 苯是重要化工原料,被英国科学家法拉第首先发现,以煤和石油为原料通过化学变化均可得到苯 |
1.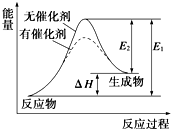 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 该反应的反应热等于E1-E2 | |
| C. | 催化剂能改变该反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
5.A、B、C、D、E、F为短周期元素,且原子序数依次增大,前5种元素质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等.下列说法中不正确的是( )
| A. | 原子半径:r(D)>r(F)>r(A) | |
| B. | D与C也能形成D2C和D2C2化合物,两种化合物中阳离子和阴离子个数比都为2:1 | |
| C. | 把2mol D的单质投入足量的水中,产生的气体体积为22.4L | |
| D. | 由A、B、C三种元素组成的18电子微粒能发生氧化反应 |
6.1.52g铜镁合金完全溶解于足量的浓硝酸中,得到NO2气体1344mL (标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,发现金属离子全部沉淀,下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 可得到2.54 g沉淀 | |
| C. | 如果是铜铝合金,则产生的NO2 的体积不会是1344mL | |
| D. | 恰好全部沉淀时,加入NaOH溶液的体积是600 mL |