题目内容
称取三份锌,分别放入三支试管中,在试管甲里加入PH=3的盐酸50ml,在试管乙里加入PH=3的醋酸50ml,在试管丙里加入PH=3的醋酸50ml及少量铜粉,塞上导管塞子,定时测定生成H2的体积.若反应终了时,生成的H2一样多,且锌没有剩余.
(1)用“>”、“=”或“<”回答以下问题:
①参加反应的锌的质量由多到少的顺序为: .
②反应完毕时,所需反应时间由多到少的顺序为: .
(2)简答:
①反应所需时间最长的一种酸的原因是: .
②乙、丙反应所需时间是否相等?答: .其原因是: .
(1)用“>”、“=”或“<”回答以下问题:
①参加反应的锌的质量由多到少的顺序为:
②反应完毕时,所需反应时间由多到少的顺序为:
(2)简答:
①反应所需时间最长的一种酸的原因是:
②乙、丙反应所需时间是否相等?答:
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)①根据锌参加的反应确定锌的质量大小;
②构成原电池的反应速率大于没有构成原电池的反应速率,没有构成原电池的反应中,氢离子浓度越大,反应速率越大;
(2)①甲中盐酸是强酸,乙中醋酸是弱酸,丙中形成了原电池;
②乙中醋酸是弱酸,丙中形成了原电池,形成原电池会大大地加快反应速率.
②构成原电池的反应速率大于没有构成原电池的反应速率,没有构成原电池的反应中,氢离子浓度越大,反应速率越大;
(2)①甲中盐酸是强酸,乙中醋酸是弱酸,丙中形成了原电池;
②乙中醋酸是弱酸,丙中形成了原电池,形成原电池会大大地加快反应速率.
解答:
解:(1)①若反应终了生成氢气的体积一样多,且没有剩余的锌,则甲、乙、丙中与酸反应的锌的质量相同,故答案为:丙=甲=乙;
②丙中有铜,铜、锌和酸构成原电池而加快反应速率,反应过程中,乙中氢离子浓度大于甲,所以乙中反应速率大于甲,反应终了,所需时间为:甲>乙>丙;
故答案为:甲>乙>丙;
(2)①盐酸是强酸随反应进行,氢离子浓度不断减小,反应速率最慢,所需时间最长,
故答案为:随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长;
②乙中醋酸是弱酸,丙中形成了原电池,形成原电池会大大地加快反应速率,速率不等,
故答案为:不相等;丙中形成了铜锌原电池,加速了锌的反应,丙中反应较乙中快.
②丙中有铜,铜、锌和酸构成原电池而加快反应速率,反应过程中,乙中氢离子浓度大于甲,所以乙中反应速率大于甲,反应终了,所需时间为:甲>乙>丙;
故答案为:甲>乙>丙;
(2)①盐酸是强酸随反应进行,氢离子浓度不断减小,反应速率最慢,所需时间最长,
故答案为:随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长;
②乙中醋酸是弱酸,丙中形成了原电池,形成原电池会大大地加快反应速率,速率不等,
故答案为:不相等;丙中形成了铜锌原电池,加速了锌的反应,丙中反应较乙中快.
点评:本题考查了反应速率与离子浓度的关系,注意原电池原理对反应速率的影响,题目难度中等.

练习册系列答案
相关题目
下列描述中,错误的是( )
| A、电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D、在镀件上电镀锌,用锌作阳极 |
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A、2NO2?N2O4△H=-57kJ/mol(反应热) | ||
B、
| ||
| C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热) | ||
D、C8H18(l)+
|
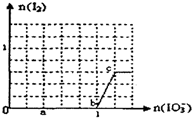 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO42- |
| B、a点时剩余NaHSO3的物质的量为1.8 mol |
| C、c点时的还原产物可能是KI或NaI |
| D、当溶液中I?与I2的物质的量之比为1:1时,加入的KIO3为1.2mol |
硅和碳的性质比较,下列说法正确的是( )
| A、晶体硅和金刚石晶体结构相似,但晶体硅的硬度比金刚石小 |
| B、硅和碳都有+4价、+2价、-4价 |
| C、硅的化合物种类比碳的化合物种类多 |
| D、碳和硅在自然界都既能以游离态存在,又能以化合态存在 |
同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
| A、它是一种共价化合物 |
| B、它既含离子键又含共价键 |
| C、它不可能与NaOH溶液反应 |
| D、它受热时难以分解 |

