题目内容
13.下列实验的操作和所用的试剂都正确的是( )| A. | 要检验己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去乙酸乙酯中少量的乙酸,可以加氢氧化钠溶液后分液 |
分析 A.先加足量溴水,排除碳碳双键的干扰,再利用酸性高锰酸钾检验甲苯;
B.浓硫酸密度较大,且放出大量热,应该将浓硫酸倒入浓硝酸中;
C.制取硝基苯时,应该用水浴加热;
D.乙酸乙酯与氢氧化钠溶液反应,应该用饱和碳酸钠溶液.
解答 解:A.先加足量溴水,排除碳碳双键的干扰,再利用酸性高锰酸钾检验甲苯,实验的操作和所用的试剂都正确,能够达到实验目的,故A正确;
B.配制浓硫酸和浓硝酸的混酸时,应该将浓硫酸沿壁缓缓倒入到浓硝酸中,否则浓硫酸密度较大,易导致酸液飞溅,故B错误;
C.因苯、硝酸易挥发,制硝基苯,应水浴加热,故C错误;
D.除去乙酸乙酯中少量的乙酸,可以加饱和碳酸钠溶液后分液,不能用氢氧化钠溶液,故D错误;
故选A.
点评 本题考查较为综合,涉及物质的检验、鉴别、分离、制备等,为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
3.下列有关物质分类或归类正确的一组是( )
①液氯、干冰、磁性氧化铁均为化合物
②王水、盐酸、漂白粉均为混合物
③明矾、小苏打、烧碱均为电解质
④牛奶、豆浆、硫酸铜溶液均为胶体.
①液氯、干冰、磁性氧化铁均为化合物
②王水、盐酸、漂白粉均为混合物
③明矾、小苏打、烧碱均为电解质
④牛奶、豆浆、硫酸铜溶液均为胶体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
4.NA代表阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA | |
| B. | 含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间 | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$4N2↑+2HNO3+9H2O中氧化产物比还原产物每多14g,转移电子数为15NA | |
| D. | 用惰性电极电解饱和碳酸钠溶液时,电路上通过2mol电子时产生气体分子总数为NA |
18.下列属于电解质的是( )
| A. | 盐酸 | B. | 蔗糖 | C. | 硫酸钠 | D. | 二氧化碳 |
5.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 68g KHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶粒 | |
| C. | 标况下2.24L丙烯分子中含有的共用电子对数目为0.9NA | |
| D. | 把5mL 11.2mol/L的浓盐酸与足量的MnO2固体混合,加热充分反应后,把产生的气体完全溶于水时,转移电子的数目为0.014NA |
8.某温度时,BaCO3在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
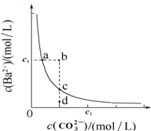

| A. | 通过蒸发可以使溶液由d点变到c点 | |
| B. | b点有BaCO3沉淀生成 | |
| C. | 升高温度,可以使d点变为c点 | |
| D. | 在a点加入Na2CO3,达平衡时c(Ba2+)≠c(CO32-),其Ksp大于c点对应的Ksp |
 苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.
苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.