题目内容
6.该小组同学用三室式电渗析法处理含Na2SO4的废水,原理如图2所示.采用惰性电极,ab、cd均为离子交换膜,在直流电的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.处理含Na2SO4废水时可以得到NaOH和H2SO4产品.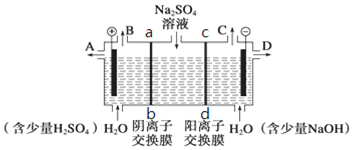
①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)D导出.通过阴离子交换膜的离子数< (填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②通电开始后,阴极附近溶液pH会增大,原因是H+在阴极放电,水的电离平衡正向移动,溶液中OH-浓度增大,pH增大
③当电路中通过1mol电子的电量时,阳极生成气体的物质的量为0.25mol.
分析 ①阴极上氢离子放电,则NaOH在阴极生成;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②水电离生成的氢离子放电,而氢氧根离子不放电;
③阳极是氢氧根离子放电生成氧气,生成1mol氧气转移4mol的电子,由此分析解答.
解答 解:①阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出;
阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,
故答案为:D;<;
②水电离出的氢离子在阴极放电,而氢氧根离子不放电,促进水的电离,导致溶液中氢氧根离子浓度增大,溶液的pH增大,
故答案为:H+在阴极放电,水的电离平衡正向移动,溶液中OH-浓度增大,pH增大;
③阳极是氢氧根离子放电生成氧气,生成1mol氧气转移4mol的电子,所以当电路中通过1mol电子的电量时,阳极生成氧气的物质的量为0.25mol,故答案为:0.25.
点评 本题考查电解池原理,明确离子放电顺序是解本题关键,根据各个电极上发生的反应来分析解答,把握电解质溶液的酸碱性确定生成的离子或物质,为易错点.

练习册系列答案
相关题目
11.可用于鉴别AlCl3 、MgCl2、NH4Cl、NaCl 四种溶液的试剂是( )
| A. | 氨水 | B. | HCl | C. | NaOH | D. | 石蕊试液 |
14.已知NaOH+Al(OH)3═Na.向集满 CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起.上述实验过程中没有发生的离子反应是( )
| A. | CO2+2OH-═CO32-+H2O | B. | Al2O3+2OH-+═2 AlO2-+H2O | ||
| C. | Al3++4OH-═AlO2-+2H2O | D. | 2 Al+2OH-+6H2O═2 AlO2-++3 H2↑ |
1.某天然碱的化学式可表示为2Na2CO3•NaHCO3•2H2O,取少量该物质溶于水得稀溶液,在溶液中逐滴滴加稀盐酸.下列离子方程式与事实不相符的是( )
| A. | CO32-+H+=HCO3- | B. | HCO3-+3CO32-+7H+═4CO2↑+4H2O | ||
| C. | 2HCO3-+5CO32-+12H+═7CO2↑+7H2O | D. | HCO3-+CO32-+3H+═2CO2↑+2H2O |
11.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种.向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀.则下列结论正确的是( )
| A. | 原气体中肯定有SO2,可能有HCl | B. | 原气体中肯定没有H2S、HBr和CO2 | ||
| C. | 原气体中肯定有SO2和 HCl | D. | 原气体中肯定没有CO2 |
18.下列实验操作或方法中,正确的是( )
| A. | 海水淡化------蒸馏 | |
| B. | 将碘单质从沙子提取出来--------过滤 | |
| C. | 盐水中获得食盐--------萃取分液 | |
| D. | 稀释浓硫酸时将水慢慢加入浓硫酸中 |
15.关于Na2O和Na2O2的叙述正确的是( )
| A. | 都是白色的固体 | B. | 都能和水反应形成强碱溶液 | ||
| C. | 都是碱性氧化物 | D. | 焰色反应的颜色都是紫色 |
16.下列变化过程,属于放热反应的是( )
| A. | NaOH溶于水 | B. | 蜡烛燃烧 | C. | 干冰气化 | D. | 碘升华 |
