题目内容
7.已知镍的金属活动性介于铁和锡之间.工业上以氧化镍矿为原料制得高纯度的金属镍,最适宜的方法为( )| A. | 氧化镍高温分解 | B. | 电解熔融的氧化镍 | ||
| C. | 高温下用氢气还原氧化镍 | D. | 高温下用焦炭还原氧化镍 |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
合电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al).
解答 解:金属铁的冶炼采用热还原法,
A.依据金属冶炼可知不活泼金属利用其氧化物分解法,故A错误;
B.电解法适用于活泼金属的冶炼,故B错误;
C.镍的金属活动性介于铁和锡之间,类似金属铁的冶炼采用热还原法,氧化镍矿为原料制得高纯度的金属镍的冶炼方法为热还原法,故C正确;
D.焦炭还原氧化镍会引入杂质碳,故D错误;
故选C.
点评 本题考查了金属冶炼的一般原理,题目难度不大,注意根据金属的活泼性不同采取相应的冶炼方法.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
17.低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究的主要课题.最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如图1:
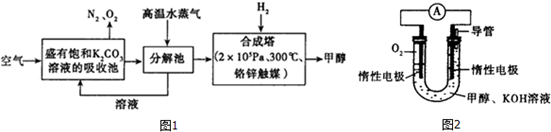
(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
①实验1前6min的反应速率v(CO2)=0.13 mol/(L.min)(保留小数点后两位,下同).
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=).

(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=).
18.下列化合物中,既含有离子键又含有共价键的是( )
①MgCl2②Ba(NO3)2③K2SO4④CH4⑤KOH ⑥H2O.
①MgCl2②Ba(NO3)2③K2SO4④CH4⑤KOH ⑥H2O.
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
2.化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
16.如表为元素周期表的一部分.回答下列问题:
(1)写出Z的阴离子结构示意图: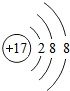 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
(2)硫的最简单氢化物与硫的低价氧化物通入水中时,发生反应的化学方程式为SO2+2H2S=3S↓+2H2O;
(3)化合物Q是由W元素与镁元素形成的.1mol化合物Q与水反应,生成2mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9:1,写出Q与水反应的化学方程式:Mg2C3+4H2O=2Mg(OH)2+C3H4↑;
(4)MnO2与500mL 一定浓度的HZ溶液反应,生成11.2L Z2(标准状况),若向反应后的溶液中加入足量铁粉,充分反应后生成44.8L(标准状况)H2,则原HZ溶液的物质的量浓度为12mol/L.
| W | 氮 | Y | |
| X | 硫 | Z |
 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.(2)硫的最简单氢化物与硫的低价氧化物通入水中时,发生反应的化学方程式为SO2+2H2S=3S↓+2H2O;
(3)化合物Q是由W元素与镁元素形成的.1mol化合物Q与水反应,生成2mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9:1,写出Q与水反应的化学方程式:Mg2C3+4H2O=2Mg(OH)2+C3H4↑;
(4)MnO2与500mL 一定浓度的HZ溶液反应,生成11.2L Z2(标准状况),若向反应后的溶液中加入足量铁粉,充分反应后生成44.8L(标准状况)H2,则原HZ溶液的物质的量浓度为12mol/L.
18.下列关于钠的叙述错误的是( )
| A. | 钠在常温下就容易被氧化 | |
| B. | 钠在空气中燃烧生成Na2O | |
| C. | 钠与氧气化合时作还原剂 | |
| D. | 钠在自然界中只能以化合物的形式存在 |