题目内容
2.化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是( )| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
分析 A.油脂在碱性条件下水解为皂化反应;
B.“亚硝酸盐”具有防腐蚀作用;
C.氯气与NaOH溶液制备漂白液;
D.二氧化硫具有漂白性,有毒.
解答 解:A.油脂在碱性条件下水解为皂化反应,则地沟油”经过加工处理后,可以用来制肥皂,故A正确;
B.“亚硝酸盐”具有防腐蚀作用,则“亚硝酸盐”可作某些食品的添加剂,故B正确;
C.氯气与NaOH溶液制备漂白液,则“84”消毒液的有效成分是NaClO,故C正确;
D.二氧化硫具有漂白性,有毒,不能作食品增白剂,故D错误;
故选D.
点评 本题考查物质的组成、性质及用途,为高频考点,把握物质的组成、性质、性质与用途为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
13.工业上用氨和二氧化碳反应合成尿素:CO2+2NH3?CO(NH2)2+H2O.已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,二氧化碳合成尿素用.若从充分利用原料的角度考虑,下列原料中较理想的一种是( )
| A. | CO | B. | 石脑油(C5H12,C6H14) | ||
| C. | CH4 | D. | 焦炭 |
10.下列变化规律中正确的是( )
| A. | H2S,HCl,PH3的热稳定性由弱到强 | |
| B. | 物质的量浓度相等的NaCl,MgCl2,AlCl3三种溶液的pH由小到大 | |
| C. | 等质量的甲烷、乙烯、乙炔充分燃烧,所耗用氧气的量由少到多 | |
| D. | CH3CH2OH,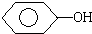 ,CH3COOH的酸性由弱到强 ,CH3COOH的酸性由弱到强 |
17. 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
7.已知镍的金属活动性介于铁和锡之间.工业上以氧化镍矿为原料制得高纯度的金属镍,最适宜的方法为( )
| A. | 氧化镍高温分解 | B. | 电解熔融的氧化镍 | ||
| C. | 高温下用氢气还原氧化镍 | D. | 高温下用焦炭还原氧化镍 |
14. 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
11.向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,溶液中无硝酸剩余,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g.下列判断正确的是( )
| A. | 原溶液中投入铁粉的物质的量是0.2mol | |
| B. | 原溶液中HNO3的浓度是1.5mol | |
| C. | 反应后的溶液中还可溶解7.2g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:1 |
13.下列溶液中NO3-的物质的量浓度与100mL 2mol•L-1的NaNO3溶液相同的是( )
| A. | 200 mL 1 mol•L-1的KNO3溶液 | B. | 50mL 1 mol•L-1的Ba(NO3)2溶液 | ||
| C. | 100 mL 0.5 mol•L-1的Mg(NO3)2溶液 | D. | 80mL 0.5 mol•L-1的Fe(NO3)3溶液 |