题目内容
18.下列化合物中,既含有离子键又含有共价键的是( )①MgCl2②Ba(NO3)2③K2SO4④CH4⑤KOH ⑥H2O.
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:①MgCl2中镁离子和氯离子之间只存在离子键,故错误;
②Ba(NO3)2中钡离子和硝酸根离子之间存在离子键,硝酸根离子中含有共价键,故正确;
③K2SO4中钾离子和硫酸根离子之间存在离子键,硫酸根离子中含有共价键,故正确;
④CH4分子中H-C原子之间只存在共价键,故错误;
⑤KOH 中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故正确;
⑥H2O分子中H-O原子之间只存在共价键,故错误.
故选C.
点评 本题考查离子键和共价键,侧重考查基本概念,明确离子键和共价键的构成及区别是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列说法中不正确的是( )
| A. | 酸与醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | CO2通入饱和苯酚钠溶液,用分液法可以得到苯酚 | |
| C. | 有机物 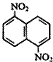 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 | |
| D. | 等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等.则A和B的分子量相差可能为18n或44n(n为正整数) |
9.PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g),有关数据如下:
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
6.下列有关水的叙述中,可以用氢键的知识来解释的是( )
| A. | 水比硫化氢气体稳定 | B. | 水的熔沸点比硫化氢高 | ||
| C. | 氯化氢气体易溶于水 | D. | 过氧化氢易分解 |
13.工业上用氨和二氧化碳反应合成尿素:CO2+2NH3?CO(NH2)2+H2O.已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,二氧化碳合成尿素用.若从充分利用原料的角度考虑,下列原料中较理想的一种是( )
| A. | CO | B. | 石脑油(C5H12,C6H14) | ||
| C. | CH4 | D. | 焦炭 |
3.下列离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O |
10.下列变化规律中正确的是( )
| A. | H2S,HCl,PH3的热稳定性由弱到强 | |
| B. | 物质的量浓度相等的NaCl,MgCl2,AlCl3三种溶液的pH由小到大 | |
| C. | 等质量的甲烷、乙烯、乙炔充分燃烧,所耗用氧气的量由少到多 | |
| D. | CH3CH2OH,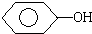 ,CH3COOH的酸性由弱到强 ,CH3COOH的酸性由弱到强 |
7.已知镍的金属活动性介于铁和锡之间.工业上以氧化镍矿为原料制得高纯度的金属镍,最适宜的方法为( )
| A. | 氧化镍高温分解 | B. | 电解熔融的氧化镍 | ||
| C. | 高温下用氢气还原氧化镍 | D. | 高温下用焦炭还原氧化镍 |