题目内容
3.阅读下列文字,填写文中带圈的数字后面的空白:某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快.他决定对其原因进行探究.
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:①Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
(1)在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化.
(2)在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
若观察到实验1中③反应速率加快,实验2中④反应速率减慢,则说明原因Ⅲ是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用.
分析 (一)根据实验中原因的分析可知,①应该是Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
②Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
(二)要证明原因Ⅲ正确,则实验1反应反应速率加快,而在实验2中反应速率减慢.
解答 解:(一)①根据原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响提出相反猜想,
故答案为:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
②根据原因ⅣCl-、SO42-均对反应具有促进作用,但Cl-影响更小提出相反猜想,
故答案为:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
(二)③根据原因ⅢCl-对反应具有促进作用,而SO42-对反应具有阻碍作用推测,
故答案为:反应速率加快;
④根据原因ⅢCl-对反应具有促进作用,而SO42-对反应具有阻碍作用推测,
故答案为:反应速率减慢.
点评 本题考查外界条件对反应速率的影响,题目难度中等,明确对照试验的设计原则为解答关键,注意掌握影响化学反应速率的因素,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
11.2015年8月12日23时,天津港瑞海公司危险品仓库发生火灾爆炸,造成人民群众的公安消防战士的重大伤亡.据悉,瑞海公司在前期出口量比较大的危险品主要有硫化钠、硫氢化钠、氯酸钠、钙、镁、钠、硝化纤维素、硝酸钙、硝酸钾、硝酸铵、氰化钠等.你认为现场不宜采用的灭火措施是( )
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
18.“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、$SO_4^{2-}$等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
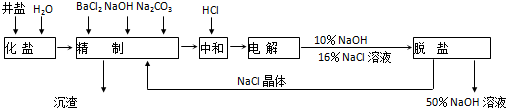
依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
根据上述数据,脱盐工序中利用通过蒸发结晶、趁热过滤(填操作名称)除去NaCl.

依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
8.下列说法正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L HF中含HF分子数目为NA | |
| B. | 60 g石英晶体中含有的Si-O键数目为2 NA | |
| C. | 标准状况下,11.2 L Cl2通人足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| D. | l L 0.1 mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |


 )的说法正确的是AD.
)的说法正确的是AD.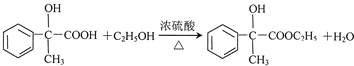 .
.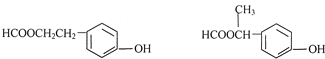 .
.