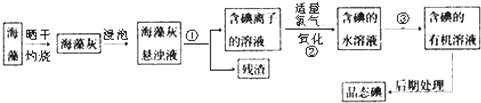
题目内容
19.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1)写出②号形成的单质的电子式
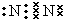 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是
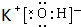 .
.(3)单质硬度最大的元素是C其氢化物结构式为
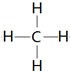 .
.(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物:
 ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.
分析 根据元素在周期表中的位置可知,①~⑨元素分别是C、N、O、Na、Al、S、Cl、Ar、K.稀有气体的最外层电子数已经达到稳定结构,所以Ar的性质最稳定,金属性越强,最高价氧化物的水化物的碱性越强,同样非金属性越强,最高价氧化物的水化物的酸性越强,因此分别是KOH和HClO4,然后结合元素化合物知识来解答.
解答 解:据元素在周期表中的位置可知,①~⑨元素分别是C、N、O、Na、Al、S、Cl、Ar、K.
(1)②号形成的单质的电子式为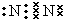 ,在这些元素中,化学性质最不活泼的是Ar,
,在这些元素中,化学性质最不活泼的是Ar,
故答案为: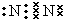 ;Ar;
;Ar;
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是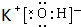 ,
,
故答案为:HClO4;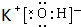 ;
;
(3)单质金刚石硬度,则单质最大的元素是C,其氢化物结构式为 ,故答案为:C;
,故答案为:C; ;
;
(4)最高价氧化物是两性氧化物的元素是Al;它的氧化物与氢氧化钠反应离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(5)用电子式表示元素④与⑥形成的化合物为 ,含离子键,为离子化合物,
,含离子键,为离子化合物,
故答案为: ;离子.
;离子.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 向工业生产的反应中加入合适的催化剂,能改变反应的焓变 |
11.2015年8月12日23时,天津港瑞海公司危险品仓库发生火灾爆炸,造成人民群众的公安消防战士的重大伤亡.据悉,瑞海公司在前期出口量比较大的危险品主要有硫化钠、硫氢化钠、氯酸钠、钙、镁、钠、硝化纤维素、硝酸钙、硝酸钾、硝酸铵、氰化钠等.你认为现场不宜采用的灭火措施是( )
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
8.下列说法正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
9.下列关于元素的叙述正确的是( )
| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.