题目内容
19.下列说法中有明显错误的是( )| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 对有气体参加的化学反应增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
分析 升高温度、加入催化剂,可增大活化分子的百分数,反应速率增大,当活化分子发生碰撞且有生成物生成时,发生化学反应,此时的碰撞为有效碰撞,以此解答.
解答 解:A.当活化分子发生碰撞且有生成物生成时,发生化学反应,此时的碰撞为有效碰撞,如没有发生化学反应,则不是有效碰撞,故A错误;
B.升高温度,可增大活化分子的百分数,有效碰撞次数增加,反应速率增大,故B正确;
C.对有气体参加的化学反应,增大压强,体系体积减小,则增大气体的浓度,单位体积内活化分子数增加,反应速率增大,故C正确;
D.加入催化剂,降低反应的活化能,增大活化分子的百分数,有效碰撞次数增加,故D正确.
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意外界条件下对化学反应速率的影响,把握有效碰撞的概念,难度不大.

练习册系列答案
相关题目
10.在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
2molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
2molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
| A. | 2022 kJ | B. | 2670 kJ | C. | 1698kJ | D. | 2346 kJ |
7.C60自被发现以来,已逐步应用到超导、材料等各个领域.下列有关说法正确的是( )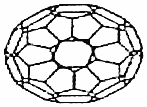

| A. | C60的摩尔质量是720 g•moL-1 | |
| B. | 1 mol C60完全燃烧生成22.4 L CO2 | |
| C. | C60属于有机化合物 | |
| D. | C60的结构与金刚石一样 |
14.某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O$?_{充电}^{放电}$ Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| A. | 充电时,阳极附近 pH 值减小 | |
| B. | 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O | |
| C. | 放电时,负极上发生反应的物质是Fe(OH)2 | |
| D. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
4.将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 氯水、盐酸、火碱、硫酸钡 | B. | 水银、硫酸、烧碱、硫酸氢钠 | ||
| C. | 铜、醋酸、石灰石、氯化铜 | D. | 臭氧、硝酸、纯碱、胆矾 |
 配制100mL 1.0mol?L-1的氯化钠溶液过程中,
配制100mL 1.0mol?L-1的氯化钠溶液过程中,