题目内容
6.等质量两份铝,分别放入足量盐酸和NaOH 中,生成氢气在同温同压下体积比为( )| A. | 2:3 | B. | 3:2 | C. | l:1 | D. | l:6 |
分析 酸碱均足量,则Al完全反应,Al失去电子相同,由电子守恒可知,H得到电子相同,以此来解答.
解答 解:等质量两份铝,分别放入足量盐酸和NaOH 中,Al完全反应,Al失去电子相同,由电子守恒可知,H得到电子相同,则生成氢气的物质的量相同,即氢气在同温同压下体积比为1:1,
故选C.
点评 本题考查金属与酸碱的反应,为高频考点,把握Al完全反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意酸碱足量及守恒法应用,题目难度不大.

练习册系列答案
相关题目
16.(1)一定温度下,Ksp[Mg3(PO3)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26.向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3PO 4,先生成Mg3(PO4)2沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=10-4mol/L.
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
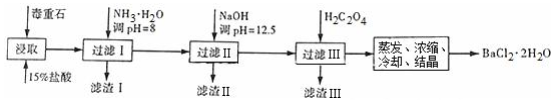
①毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.
②加入NH3•H2O调节PH=8可除去Fe3+(填离子符号),滤渣II中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是D
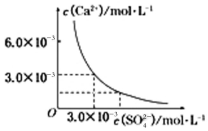
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大.
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:

①毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.
②加入NH3•H2O调节PH=8可除去Fe3+(填离子符号),滤渣II中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是D

A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大.
17.已知某溶液中存在较多的H+、SO42-、NO3-,该溶液中还可能大量存在的离子组是( )
| A. | Na+、NH4+、Cl+ | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、Fe2+ | D. | K+、SiO32-、Cl- |
11.设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA | |
| B. | MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA | |
| C. | 高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
18.下列化合物中,可以通过置换反应一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3.
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3.
| A. | ①②③④ | B. | ①②③ | C. | ①④ | D. | ①③ |
15.已知反应:①H2O(g)═H2O(l)△H=-44kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
若标准状况下2.24L的H2恰好与足量O2反应生成H2O(l),则整个过程放出的热量为( )
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
若标准状况下2.24L的H2恰好与足量O2反应生成H2O(l),则整个过程放出的热量为( )
| A. | 28.58kJ | B. | 24.18kJ | C. | 57.16kJ | D. | 48.36kJ |
16.设NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 6.2 g Na2O所含的离子数为0.2 NA | |
| B. | 46 gNO2与N2O4的混合气体中所含的原子数是3NA | |
| C. | 2.8 gN2中含有共用电子对的数目为0.1 NA | |
| D. | 0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA |