题目内容
11.元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.(1)与氯元素同族的短周期元素的原子结构示意图为
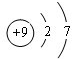 .
.(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是cd.
a.HCl、HBr、HI水溶液的酸性 b.Cl2、Br2、I2的熔点
c.HCl、HBr、HI的热稳定性 d.Cl2、Br2、I2的氧化性
(3)工业上,通过如下转化可制得KCl03晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
①完成Ⅰ中反应的总化学方程式:
1NaCl+3H2O═1NaClO3+3H2↑.
②Ⅱ反应过程能析出KCIO3晶体而无其他晶体析出的原因是室温下KClO3在水中的溶解度明显小于其它晶体
(4)一定条件下,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.
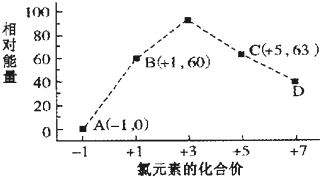
①D是ClO4-(填离子符号).
②B→A+c反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
分析 (1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,据此书写F的原子结构示意图;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体,
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;
相同温度下,溶解度小的物质先析出;
(4)一定条件下,在水溶液1 mol Cl-、ClOx-(x=1,2,3,4,)的能量(kJ)相对大小如图所示.
①D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol.
解答 解:(1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,则F的原子结构示意图为 ,
,
故答案为: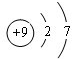 ;
;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故答案为:cd;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体,
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为NaCl+3H2O═NaClO3+3H2↑,
故答案为:1;3;1;3;H2↑;
②相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3,
故答案为:室温下KClO3在水中的溶解度明显小于其它晶体;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol.
点评 本题以卤族元素为载体考查了氧化还原反应、热化学反应、非金属强弱的判断方法等知识点,根据物质的性质、原子结构结合元素周期律等知识点来分析解答,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
| A. | 某有机物的结构简式如图所示 ,该物质属于芳香族化合物是苯的含氧衍生物,含有两种含氧官能团 ,该物质属于芳香族化合物是苯的含氧衍生物,含有两种含氧官能团 | |
| B. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 | |
| C. | 总质量一定时,乙炔和乙醛(CH3CHO)无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH2═CHCOOH)和山梨酸(CH3CH═CHCH═CHCOOH)不是同系物,它们与氢气充分反应后的产物才是同系物 |
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 滴入KI试液 | 检验淀粉是否已完全水解 |
| C | 先滴入Ba(NO3)2溶液.产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 向乙醇溶液加入钠粒 | 测定乙醇分子中含有羟基 |
| A. | A | B. | B | C. | C | D. | D |
| A. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) | |
| B. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) |
| A. | 此电池能发出蓝色火焰 | |
| B. | H2为正极,O2为负极 | |
| C. | 工作时,电解液的pH不断增大 | |
| D. | 此电池反应只生成水,对环境没有污染 |
| A. | 平面正四边形 | B. | 三角锥形 | C. | 平面三角形 | D. | 空间正四面体 |
| A. | 将AlCl3溶液与Na2S溶液混合 | B. | 将H2S气体通入Al2(SO4)3溶液中 | ||
| C. | 将Al(NO3)3固体与K2S固体混合 | D. | 将金属铝与硫混合加热 |
 ,A的结构简式CH2=CH2.
,A的结构简式CH2=CH2. ,反应类型取代反应.
,反应类型取代反应.