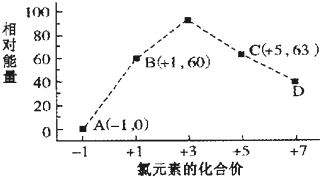
题目内容
1.一定条件下,在2L密闭容器中将1.0molN2与3.0mol H2合成氨,反应到2s时测得N2的物质的量浓度为0.3mol•L-1,当用氢气浓度的减少来表示该反应的反应速率时,该反应的反应速率为( )| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
分析 根据氮气浓度的变化量计算参加反应的氢气的物质的量浓度,再根据v=$\frac{△c}{△t}$计算v(H2).
解答 解:2s时测得N2的浓度为0.3mol/L,则氮气物质的量浓度变化量=$\frac{1mol}{2L}$-0.3mol/L=0.2mol/L,N2+3H2=2NH3,
化学方程式计算得到消耗的氢气的物质的量浓度是0.6mol/L,所以当用氢气浓度的减少来表示该反应的反应速率时,该反应的反应速率=$\frac{0.6mol/L}{2s}$=0.3mol/(L•s).
故选D.
点评 本题考查学生化学反应速率的计算方法知识,注意公式的记忆和应用是关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1.下列叙述不正确的是( )
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
6.下列物质的除杂方式:①SO2中混有的SO3杂质可以让混合气体通过稀硫酸除去;②MnO2中混有的少量有机物,可以用加热的方法除去;③CO2中混有的SO2气体可以通过饱和NaHSO3溶液除去;④金属铜中含有的少量银和锌可以通过电解精炼的方式除去;⑤KNO3中含有的少量NaCl可以通过重结晶的方法除去,其中合理的是( )
| A. | ①②④⑤ | B. | 全部 | C. | ②④⑤ | D. | ②③④⑤ |
13.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中正确的是( )
| A. | 钠块在乙醇的液面上游动 | B. | 钠块熔化成小球 | ||
| C. | 钠块沉在乙醇液面的下面 | D. | 钠块表面没有气体放出 |
10.某有机物的结构简式为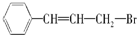 ,它可能具有的性质是( )
,它可能具有的性质是( )
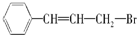 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 能使溴水褪色,但不能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol 该有机物可以与4 mol Br2加成 | |
| D. | 在NaOH水溶液中可以发生水解反应 |
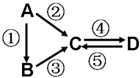 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: .
.