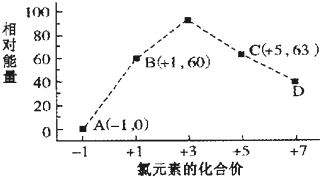
题目内容
6.如表中的实验操作能达到实验目的是( )| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 滴入KI试液 | 检验淀粉是否已完全水解 |
| C | 先滴入Ba(NO3)2溶液.产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 向乙醇溶液加入钠粒 | 测定乙醇分子中含有羟基 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.碘单质遇到淀粉变蓝色;
C.硝酸根离子在酸溶液中具有氧化性,可能含有SO32-,被氧化生成SO42-;
D.乙醇溶液中含有乙醇和水,二者都和Na反应.
解答 解:A.双氧水能将FeSO4氧化为三价铁,可证明H2O2的氧化性大于Fe3+,故A正确;
B.碘单质遇到淀粉变蓝色,碘化钾试液不能检验淀粉是否水解,故B错误;
C.可能含有SO32-,被氧化生成SO42-,应先加入盐酸,再加入氯化钡检验,故C错误;
D.乙醇溶液中含有乙醇和水,二者都和Na反应,所以不能用乙醇溶液和Na反应检验乙醇中羟基,故D错误;
故选A.
点评 本题考查化学实验方案的评价,涉及官能团检验、氧化还原反应、气体的检验及物质的性质,注重基础知识的考查,题目难度中等.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
16.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1.下列叙述不正确的是( )
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
14.下列各组物质的燃烧热相等的是( )
| A. | C和CO | B. | 1moC和2moC | C. | 1moC2H2和2molC | D. | SO2和CO2 |
1.下列说法正确的是( )
| A. | N2(g)+3H2(g)?2NH3(g)△H<0其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 | |
| B. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| C. | 合成氨反应是放热反应,所以工业合成氨时温度越低越好 | |
| D. | 恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,混合气体的平均相对分子质量不变可以作为其达到化学平衡状态的标志 |
15.通常用来衡量一个国家石油化工发展水平标志的是( )
| A. | 甲烷的产量 | B. | 乙烯的产量 | C. | 乙醇的产量 | D. | 硫酸的产量 |
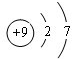 .
.