题目内容
目前,世界上生产的镁有60%来自海水,其生产流程图如下
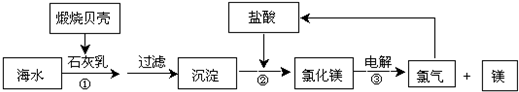
(1)贝壳的主要化学成分为 (写化学式)
(2)写出反应②的离子方程式:
(3)Mg与CO2反应时,有白色粉末并有黑色固体生成.请写出Mg与CO2反应的化学方程式,并用双线桥标出电子转移的方向与数目.
其中还原剂是 .

(1)贝壳的主要化学成分为
(2)写出反应②的离子方程式:
(3)Mg与CO2反应时,有白色粉末并有黑色固体生成.请写出Mg与CO2反应的化学方程式,并用双线桥标出电子转移的方向与数目.
其中还原剂是
考点:海水资源及其综合利用
专题:元素及其化合物
分析:流程分析,海水晒盐得到的卤水中加入煅烧贝壳得到的氧化钙溶于水生成的氢氧化钙石灰乳,用来沉淀镁离子,过滤得到氢氧化镁加入盐酸溶解富集镁元素得到氯化镁,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中脱水得到固体氯化镁,电解熔融氯化镁得到镁和氯气;
解答:
解:(1)贝壳的主要化学成分为碳酸钙,CaCO3;
故答案为:CaCO3 ;
(2)反应②是氢氧化镁溶解于盐酸中反应生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)Mg与CO2反应时,有白色粉末氧化镁并有黑色固体碳生成,Mg与CO2反应的化学方程式为:2Mg+CO2
C+2MgO,反应中镁失电子,碳得到电子生成碳单质,双线桥表示的氧化还原反应为: ,反应中镁化合价从0价变化为+2价,做还原剂;
,反应中镁化合价从0价变化为+2价,做还原剂;
故答案为: ;Mg
;Mg
故答案为:CaCO3 ;
(2)反应②是氢氧化镁溶解于盐酸中反应生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)Mg与CO2反应时,有白色粉末氧化镁并有黑色固体碳生成,Mg与CO2反应的化学方程式为:2Mg+CO2
| ||
 ,反应中镁化合价从0价变化为+2价,做还原剂;
,反应中镁化合价从0价变化为+2价,做还原剂;故答案为:
 ;Mg
;Mg
点评:本题考查了海水提镁的流程和反应原理,氧化还原反应电子转移表示方法,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列图标与回收内容不能对应的是( )
A、 玻璃 |
B、 瓜果壳 |
C、 电池 |
D、 剩饭菜 |
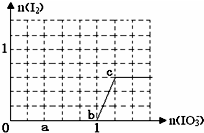 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0--b:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b-c间I2是既是还原产物又是氧化产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.8mol |