题目内容
20.工业上利用N2和H2合成氨,其化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<0(1)将一定量的N2和H2的混合气放入某密闭容器中发生上述反应.
①下列措施中可提高氢气的转化率的有CD(填字母).
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气
②在一定温度和压强下,将H2和N2按体积比3:1在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数为$\frac{1}{7}$,此时N2的转化率为25%.
(2)某厂每天产生600m3含氨废水(NH3 的浓度为153mg/L,废氨水密度为1g/cm-3).该厂处理废水的方法:将废水加热得到NH3,使废水中NH3的浓度降为17mg/L.再对加热蒸发得到的NH3用一定量空气氧化.发生的主要反应如下:
4NH3+5O2═4NO+6H2O 4NO+3O2+2H2O═4HNO3
副反应为:4NH3+3O2═2N2+6H2O
①该厂每天通过加热蒸发可得到NH3的物质的量是4800mol.
②若氧化过程中90% NH3转化为硝酸,10% NH3发生了副反应,则该厂每天消耗标准状况下的空气1008立方米(假设废水加热前后的体积和密度近似认为不变,空气中氧气的体积分数20%).
分析 (1)①A.升高温度,平衡向逆反应方向移动,则转化率减小;
B.使用催化剂平衡不移动,转化率不变;
C.增大压强平衡向正反应方向移动,转化率增大;
D.循环利用和不断补充氮气,可使平衡向正反应方向移动,转化率增大;
②设起始时H2的物质的量为3mol,N2为1mol,平衡时N2转化了xmol,
N2(g)+3H2(g)?2NH3(g)
起始:1mol 3mol 0
转化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{7}$
x=0.25,由此分析解答;
(2)①计算氨气的浓度变化,根据n=cV计算物质的量;
②根据方程式得出反应的关系式,可根据关系式计算.
解答 解:(1)①A.升高温度,平衡向逆反应方向移动,则转化率减小,故A错误;
B.使用催化剂平衡不移动,转化率不变,故B错误;
C.增大压强平衡向正反应方向移动,转化率增大,故C正确;
D.循环利用和不断补充氮气,可使平衡向正反应方向移动,转化率增大,故D正确.
故答案为:CD;
②设起始时H2的物质的量为3mol,N2为1mol,平衡时N2转化了xmol,
N2(g)+3H2(g)?2NH3(g)
起始:1mol 3mol 0
转化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{7}$
x=0.25,
此时N2的转化率为$\frac{0.25}{1}$×100%=25%,
故答案为:25%;
(2)①n(NH3)=$\frac{(153-17)mg•{L}^{-1}}{17g•mo{l}^{-1}}$×10-3g/mg×600m3×103L/m3=4800mol,
故答案为:4800;
②根据下列发生的主反应:
4NH3+5O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O,4NO+3O2+2H2O=4HNO3
得主反应中氨气与氧气的物质的量有如下关系式:NH3~2O2
n(O2)主反应=4800 mol×90%×2=8640 mol
根据下列副反应:
4NH3+3O2=2N2+6H2O
n(O2)副反应=4800 mol×10%×$\frac{3}{4}$=360mol
V(空气)=(8640+360)mol×22.4L/mol×10-3m3/L÷20%=1008m3
故答案为:1008.
点评 本题考查化学平衡的计算,题目较为综合,且难度较大,易错点为(2),注意根据质量守恒利用关系法计算.

 名校课堂系列答案
名校课堂系列答案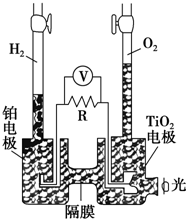 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | a点对应溶液中含有的分子有H2O、HClO、HCl、Cl2 | |
| B. | b点对应溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-) | |
| C. | c点对应溶液中:c(K+)=c(Cl-)+c(ClO-)+c(HClO) | |
| D. | 实验过程中可以用pH试纸测定溶液的pH |
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
| A. | K2SO4 | B. | H2SO4 | C. | Ba(OH)2 | D. | AgNO3 |
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
 的是( )
的是( )| A. | NaCl | B. | HCl | C. | NaOH | D. | HNO3 |
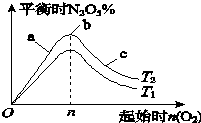 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
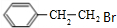 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.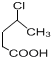 制备
制备 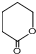 的合成路线流程
的合成路线流程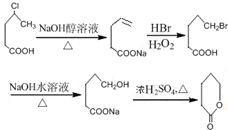 .
.