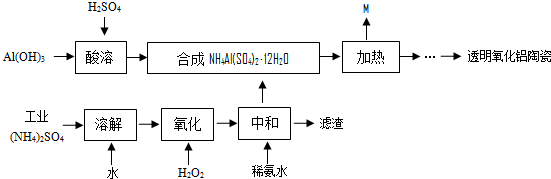
题目内容
5.在pH=x某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>x,则该电解质可能是( )| A. | K2SO4 | B. | H2SO4 | C. | Ba(OH)2 | D. | AgNO3 |
分析 在pH=x某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>x,电解后溶液pH增大,电解质可能是不饱和的强碱、强碱弱酸盐、强碱形成的氯化物、强碱形成的溴化物、强碱形成的碘化物等,据此分析解答.
解答 解:A.电解K2SO4溶液时,阴极上H+放电、阳极上OH-放电,所以相当于电解H2O,溶质的物质的量不变,溶液体积减小,溶液浓度增大,但K2SO4是强酸强碱盐,溶液仍然呈中性,pH不变,故A不选;
B.电解H2SO4溶液,阴极上H+放电、阳极上OH-放电,所以相当于电解H2O,溶质的物质的量不变,溶液体积减小,溶液浓度增大,溶液浓度增大,c(H+)增大,pH减小,故B不选;
C.电解Ba(OH)2溶液,阴极上H+放电、阳极上OH-放电,所以相当于电解H2O,溶质的物质的量不变,溶液体积减小,溶液浓度增大,c(OH-)增大,pH增大,故C选;
D.电解AgNO3溶液,阴极上Ag+放电、阳极上OH-放电,导致溶液中c(H+)增大,pH减小,故D不选;
故选C.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,知道各个电极上发生的反应及电解后溶液中各微粒浓度变化,注意总结归纳,题目难度不大.

练习册系列答案
相关题目
16.下列关于平衡常数K,不正确的是( )
| A. | 每一个反应,在一个温度下,有一个K值 | |
| B. | K越大,表示正向反应的倾向大,反应完全 | |
| C. | K值只能说明反应的最大限度,不能说明反应的速度 | |
| D. | 吸热反应的K值大于所有放热反应的K值 |
13.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应方程如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g).下列叙述错误的是( )
| A. | 使用合适的催化剂可大大提高生产效率 | |
| B. | 由反应需在300℃进行,可知该反应是吸热反应 | |
| C. | 增大原料气中CO2的百分含量,可以提高H2的转化率 | |
| D. | 70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |
12.下列溶液中,与100mL 0.5mol•L-1NaCl 溶液中所含的Cl-物质的量浓度相同的是( )
| A. | 25 mL 0.5 mol•L-1HCl 溶液 | B. | 200 mL 0.25 mol•L-1 AlCl3溶液 | ||
| C. | 50 mL 1 mol•L-1 KCl 溶液 | D. | 100 mL 0.5 mol•L-1 MgCl2 溶液 |
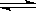 Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答: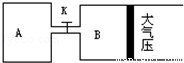
 器恢复原来反应前的体积,可采取的措施是____________________。
器恢复原来反应前的体积,可采取的措施是____________________。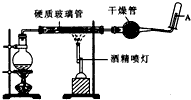 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.