题目内容
(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
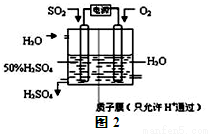
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
(1)① 66.7% 1.25 c ② T2 ③ 0<x<0.8
(2)2SO2+O2+2H2O=2H2SO4 SO2+2H2O -2e- = SO42-+4H+
【解析】
试题分析:(1)①在8min时反应达平衡,SO3的物质的量减小了0.4mol,SO3的转化率α=
 ×100%= 66.7%;T1℃反应达平衡时, 反应达平衡的物质的量0.2mol,同时生成0.2mol O2和0.4mol SO2,c(SO3)=0.2mol /L,c(O2)= 0.2mol /L ,c(SO2)= 0.4mol /L,所以2SO2(g)+O2(g)
×100%= 66.7%;T1℃反应达平衡时, 反应达平衡的物质的量0.2mol,同时生成0.2mol O2和0.4mol SO2,c(SO3)=0.2mol /L,c(O2)= 0.2mol /L ,c(SO2)= 0.4mol /L,所以2SO2(g)+O2(g)  2SO3(g)的平衡常数k=0.2mol /L×(0.4mol /L)2÷(0.2mol /L)2=0.8,则2SO3(g)
2SO3(g)的平衡常数k=0.2mol /L×(0.4mol /L)2÷(0.2mol /L)2=0.8,则2SO3(g)  2SO2(g)+O2(g)的平衡常数=1/k= 1.25。②由△H<0,升高温度平衡逆向移动,平衡常数减小,即温度越低平衡常数越大,所以温度最低的是T2。③要使SO3的浓度减小,平衡逆向移动,计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行。Qc=(0.2mol /L)2÷[X×(0.2mol /L)2]>1.25,解得X<0.8,即x的取值范围是0<x<0.8。(2)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;总反应的化学方程式为2SO2+O2+2H2O=2H2SO4,阳极电极反应为:SO2+2H2O=SO42-+4H++2e-。
2SO2(g)+O2(g)的平衡常数=1/k= 1.25。②由△H<0,升高温度平衡逆向移动,平衡常数减小,即温度越低平衡常数越大,所以温度最低的是T2。③要使SO3的浓度减小,平衡逆向移动,计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行。Qc=(0.2mol /L)2÷[X×(0.2mol /L)2]>1.25,解得X<0.8,即x的取值范围是0<x<0.8。(2)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;总反应的化学方程式为2SO2+O2+2H2O=2H2SO4,阳极电极反应为:SO2+2H2O=SO42-+4H++2e-。
考点:考查化学平衡计算。

 2Z(g)的平衡常数为1 600。此温度下,
2Z(g)的平衡常数为1 600。此温度下,


 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑