题目内容
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是

A.c隔膜为阴离子交换膜、d隔膜为阳离子交换膜
B.A溶液为硫酸,B溶液为氢氧化钠
C.a气体为氢气,b气体为氧气
D.该电解反应的总方程式为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
C
【解析】
试题分析:在电解池中,存在的隔膜c可以阻止阴离子向阴极移动,隔膜d可以阻止阳离子向阳极移动,正确;B.电解Na2SO4溶液后,溶液中的阴离子放电能力:OH-> SO42-,阴离子OH-放电变为O2逸出,电极反应式是:4OH—4e-= O2↑+2H2O使附近的溶液中H+浓度增大,所以A溶液为硫酸,在B处,应用溶液中的阳离子的放电能力:H+>Na+,所以在阴极2H++2e-=H2↑,破坏了附近的水的电离平衡,溶液中OH-的浓度增大,因此B溶液为氢氧化钠,正确;C.通过选项B的分析可知:a气体为氧气,b气体为氢气,错误;D.根据电极反应式可知,该电解反应的总方程式为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑,正确。
2H2SO4+4NaOH+O2↑+2H2↑,正确。
考点:考查电解反应原理的应用的知识。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
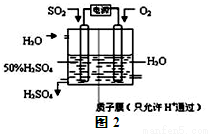


 溶液中通入过量
溶液中通入过量
