题目内容
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,
2Z(g)的平衡常数为1 600。此温度下,
在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
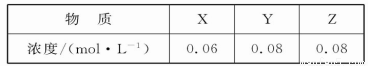
下列说法正确的是
A.此时v(正)<v(逆)
B.平衡时Y的浓度为0.05 mol·L-1
C.平衡时X的转化率为40%
D.增大压强使平衡向正反应方向移动,平衡常数增大
B
【解析】
试题分析:A.根据Qc= =0.082/(0.06×0.083)=208.3<1 600,反应没有达到平衡,向正反应方向移动,v(正)>v(逆),A错误;B.若达到平衡时Y的浓度为0.05 mol·L-1,则Y在上面某时刻浓度的基础上又反应了0.03 mol·L-1,所以X、Y、Z的平衡浓度分别为0.05 mol·L-1、0.05 mol·L-1、0.1 mol·L-1,所以此时的Qc=0.12/(0.05×0.053)=1 600,与此温度下的平衡常数数值相等,所以此时达到平衡状态, B正确;C.根据表中数据可知起始时刻X、Y的浓度分别为0.1 mol·L-1、0.2 mol·L-1,达到平衡时X的浓度为0.05 mol·L-1,所以X的转化率为0.05 mol·L-1/0.1 mol·L-1×100%=50%,C错误;D.增大压强,平衡正向移动,但是平衡常数不变,D错误,选B。
=0.082/(0.06×0.083)=208.3<1 600,反应没有达到平衡,向正反应方向移动,v(正)>v(逆),A错误;B.若达到平衡时Y的浓度为0.05 mol·L-1,则Y在上面某时刻浓度的基础上又反应了0.03 mol·L-1,所以X、Y、Z的平衡浓度分别为0.05 mol·L-1、0.05 mol·L-1、0.1 mol·L-1,所以此时的Qc=0.12/(0.05×0.053)=1 600,与此温度下的平衡常数数值相等,所以此时达到平衡状态, B正确;C.根据表中数据可知起始时刻X、Y的浓度分别为0.1 mol·L-1、0.2 mol·L-1,达到平衡时X的浓度为0.05 mol·L-1,所以X的转化率为0.05 mol·L-1/0.1 mol·L-1×100%=50%,C错误;D.增大压强,平衡正向移动,但是平衡常数不变,D错误,选B。
考点:考查化学反应方向,转化率、平衡浓度的计算等知识。

(10分)已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g) ?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=______ __.
?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=______ __.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式____ ____,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
C+CO2 2CO;ΔH1>0,反应速率v1,N2+3H2
2CO;ΔH1>0,反应速率v1,N2+3H2 2NH3;ΔH2<0,反应速率v2。如果升高温度,则v1和v2的变化是
2NH3;ΔH2<0,反应速率v2。如果升高温度,则v1和v2的变化是
A.同时增大 B.同时减少 C.v1增大,v2减少 D.v1减少,v2增大
(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
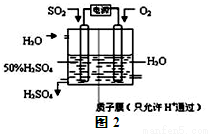
 H+ + OH- ;下列叙述正确的是
H+ + OH- ;下列叙述正确的是 pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是 CO(g) =
CO(g) =  Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH =-15.73 kJ/mol
CO2(g) ΔH =-15.73 kJ/mol