题目内容
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是

A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
B
【解析】
试题分析:A.X和Y不连接时,铜可以置换出银单质,正确;B.X和Y用导线连接时,构成原电池,Ag做正极,发生还原反应,Cu作负极,发生氧化反应,错误;C.若X接直流电源的正极,Y接负极,构成电解池,Ag做阳极,Cu作阴极,Ag+向铜电极移动,正确;D.无论X和Y是否连接,铜都会失去电子变成铜离子,正确。
考点:考查电化学原理。

 智慧小复习系列答案
智慧小复习系列答案(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
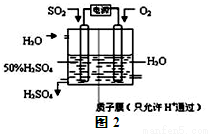
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
下列陈述I、II正确并且有因果关系的是
选项 | 叙述I | 叙述II |
A | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
B | Ba(OH)2可与盐酸反应 | Ba(OH)2可用于治疗胃酸过多 |
C | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
D | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
 pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是 2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是