题目内容
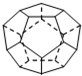 (1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有
(1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有(2)氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.写出铬原子的基态的核外电子排布式
(3)某些含氧的有机物也可形成氢键,例如
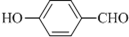 的沸点比
的沸点比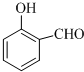 高,其原因是
高,其原因是(4)H+可与H2O形成H3O+,H3O+中O原子采用
(5)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过
考点:原子核外电子排布,极性分子和非极性分子,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)利用均摊法分析晶体结构,每个碳原子被3个正五边形共用,所以每个正五边形中含有5×
个,根据原子守恒计算五边形个数;
(2)Cr的原子序数为24,根据能量最低原理书写基态原子的电子排布式;,电子最后填入的能级是d能级的元素属于d区元素,包括ⅢB~ⅦB及Ⅷ族;根据相似相溶判断分子的极性;
(3)根据氢键对物理性质的影响分析,同类物质分子内氢键熔点低于分子间氢键;
(4)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(5)石墨是层状结构的,每层每个C原子与周围的三个碳原子成σ键,键角为120°(这些都是实验数据得出的),根据价层电子对互斥理论分析;
| 1 |
| 3 |
(2)Cr的原子序数为24,根据能量最低原理书写基态原子的电子排布式;,电子最后填入的能级是d能级的元素属于d区元素,包括ⅢB~ⅦB及Ⅷ族;根据相似相溶判断分子的极性;
(3)根据氢键对物理性质的影响分析,同类物质分子内氢键熔点低于分子间氢键;
(4)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(5)石墨是层状结构的,每层每个C原子与周围的三个碳原子成σ键,键角为120°(这些都是实验数据得出的),根据价层电子对互斥理论分析;
解答:
解;(1)设C20分子中含x个正五边形,通过观察图形可知,每一个顶点为三个正五边形共用,则每个正五边形占有该顶点的
,因此,每个正五边形占有碳原子数为5×
个,这个基本结构单元的碳原子数为x×5×
=20,因此,C20分子中含有正五边形个数x=12;每一条边为两个正五边形共用,每个正五边形只占有这条边的
,故C-C键的数目为12×5×
=30个,即C20分子中共有30条棱边,由分子构成,为分子晶体,
故答案为:12;30;分子晶体;
(2)Cr的原子序数为24,根据能量最低原理可知基态原子的电子排布式为1s22s22p63s23p63d54s1,属于d区元素;CCl4、CS2等为非极性分子,CrO2Cl2能与CCl4、CS2等互溶,根据相似相溶可知,CrO2Cl2为非极性分子,
故答案为:1s22s22p63s23p63d54s1;d;非极性;
(3)邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛,
故答案为:邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,分子间氢键使分子间作用力增大;
(4)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(5)石墨每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2P轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构.因碳纳米管结构与石墨类似,
故答案为:sp2 ;范德华力.
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:12;30;分子晶体;
(2)Cr的原子序数为24,根据能量最低原理可知基态原子的电子排布式为1s22s22p63s23p63d54s1,属于d区元素;CCl4、CS2等为非极性分子,CrO2Cl2能与CCl4、CS2等互溶,根据相似相溶可知,CrO2Cl2为非极性分子,
故答案为:1s22s22p63s23p63d54s1;d;非极性;
(3)邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛,
故答案为:邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,分子间氢键使分子间作用力增大;
(4)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(5)石墨每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2P轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构.因碳纳米管结构与石墨类似,
故答案为:sp2 ;范德华力.
点评:本题考查较为综合,涉及电子排布式、晶胞的计算、分子的极性、杂化类型等知识,解答时注意利用均摊法结合数学知识分析晶体的结构.题目难度中等,学生在学习过程中重点在于能利用模型解决问题,侧重于方法.

练习册系列答案
相关题目
 (1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式
(1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式 对如图中电极加以必要的连接并填空:
对如图中电极加以必要的连接并填空: 北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: