题目内容
6.下列有关说法正确的是( )| A. | 1 mol FeBr2与足量氯气反应时,理论上转移的电子数约为3×6.02×1023 | |
| B. | 常温下,pH均为3的三种溶液:①HCl溶液 ②H2SO4溶液③CH3COOH溶液,各自溶质的物质的量浓度大小顺序为①=②<③ | |
| C. | 电解熔融NaCl或AlCl3制取Na或Al | |
| D. | 一定条件下反应Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)达到平衡后,滴加少量浓硫酸,重新达平衡前,2v正(Cr2O72-)<v逆(CrO42-) |
分析 A.氯气可以氧化亚铁离子、碘离子,反应方程式为:2FeI2+3Cl2=2FeCl3+2I2,根据方程式计算参加反应氯气物质的量,再根据Cl元素化合价变化计算转移电子;
B.醋酸为弱酸,元素为一元强酸,硫酸为二元强酸,pH相同时醋酸浓度最大,硫酸浓度最小;
C.氯化铝为共价化合物,熔融氯化铝不导电;
D.达到平衡时2v正(Cr2O72-)=v逆(CrO42-),加入稀硫酸后氢离子浓度增大,平衡向着逆向移动,据此判断2v正(Cr2O72-)与v逆(CrO42-)的大小.
解答 解:A.氯气可以氧化亚铁离子、碘离子,反应方程式为:2FeI2+3Cl2=2FeCl3+2I2,1molFeI2反应需要Cl2的物质的量为1mol×$\frac{3}{2}$=1.5mol,反应中Cl元素化合价由0价降低为-1价,故转移电子为1.5mol×2=3mol,即转移电子数为3×6.02×1023,故A正确;
B.盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,三种酸中c(HCl)=c(H+),2c(H2SO4)=c(H+),c(CH3COOH)>c(H+),所以要使氢离子浓度相等,则三种酸的物质的量浓度大小顺序是c(CH3COOH)>c(HCl)>c(H2SO4),即②<①<③,故B错误;
C.电解熔融氯化钠可以获得钠,但是氯化铝为共价化合物,熔融氯化铝不导电,无法通过电解熔融氯化铝获得铝,故C错误;
D.达到平衡时2v正(Cr2O72-)=v逆(CrO42-),加入稀硫酸后氢离子浓度增大,平衡向着逆向移动,则2v正(Cr2O72-)<v逆(CrO42-),故D正确;
故选AD.
点评 本题考查较为综合,涉及pH的计算、电离平衡及其影响、金属冶炼、电解原理等知识,明确电离平衡及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的灵活应用能力.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案①我国历史上铅的使用早于锌;
②锌和铅有相似性但锌更活泼;
③铅蓄电池放电时,正负极的质量均增加;
④“升炼倭铅”属于热还原法冶炼金属.
| A. | 有一句正确 | B. | 有两句正确 | C. | 有三句正确 | D. | 四句均正确 |
| A. | 能使石蕊溶液呈红色的溶液:Fe2+、Na+、Ba2+、Cr2O72-可以大量共存 | |
| B. | 氢氧化钡溶液与等物质的量的稀硫酸混合,离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 50℃,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 25℃,pH相同的NaOH、CH3COONa、Na2CO3、NaHCO3溶液的浓度c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
| A. | 加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 水电离出的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、SO32- | |
| C. | 使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3- |
| A. | 一滴香: | B. | 扑热息痛: | C. | 维生素B5 | D. | 芬必得: |
| A. | x=2 | |
| B. | Fe2+、S2O32-都是还原剂 | |
| C. | 硫元素被氧化,铁元素被还原 | |
| D. | 每生成1 mol Fe2O4,则转移电子数为3 mol |

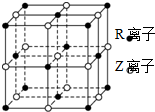 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.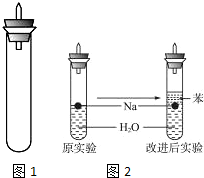 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图: