题目内容
根据如图,下列判断中正确的是( )
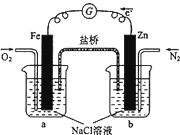

| A、烧杯a中发生反应O2+4H++4e═ˉ2H2O,溶液pH降低 |
| B、烧杯b中发生反应为2Zn-4eˉ═2Zn2+ |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,NaCl溶液显中性,Zn比Fe活泼,Zn为负极,失去电子,Fe为正极,正极上氧气得到电子,以此来解答.
解答:
解:A.a中Fe为正极,发生O2+2H2O+4e-=4OH-,碱性增强,pH增大,故A错误;
B.b烧杯中Zn为负极,则b中发生的反应为Zn-2e-=Zn2+,故B正确;
C.电子不能流经溶液,溶液中由离子的定向移动导电,故C错误;
D.烧杯a中发生的氧气得到电子生成氢氧根离子的反应,电极反应为:O2+2H2O+4e-=4OH-,铁不被氧化,则向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成,故D错误.
故选B.
B.b烧杯中Zn为负极,则b中发生的反应为Zn-2e-=Zn2+,故B正确;
C.电子不能流经溶液,溶液中由离子的定向移动导电,故C错误;
D.烧杯a中发生的氧气得到电子生成氢氧根离子的反应,电极反应为:O2+2H2O+4e-=4OH-,铁不被氧化,则向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成,故D错误.
故选B.
点评:本题考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,下列热化学方程式正确的是( )
A、CH3OH(l)+
| ||
| B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-725.8 kJ?mol-1 | ||
C、CH3OH(l)+
| ||
| D、2CH3OH(l)+3O2(g)=2 CO2(g)+4H2O(g);△H=-1451.6 kJ?mol-1 |
下列各组变化中,前者是物理变化,后者是化学变化的是( )
| A、煤的气化、煤的干馏 |
| B、用盐酸除金属表面的锈、食盐水导电 |
| C、焰色反应、石油的裂化 |
| D、热的饱和KNO3溶液降温析出晶体、二硫化碳洗涤试管内壁上的硫 |
某烯烃(只含一个碳碳双键)与氢气加成后的产物是:则该烯烃的结构式可能有几种( )


| A、1 | B、2 | C、3 | D、4 |
下列离子方程式书写正确的是( )
A、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
| C、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述错误的是( )
| A、原子半径的大小顺序:Y>Z>W>X |
| B、元素W的最高价氧化物对应水化物的酸性比Z的强 |
| C、元素X的两种氢化物中,常温常压下均为液态,有一种含氢键,另一种没有氢键 |
| D、化合物YX、ZX2的化学键类型不相同 |
下列物质不能为动物体提供能量的是( )
| A、脂肪 | B、维生素 |
| C、糖类 | D、蛋白质 |
下列化学反应所对应的离子方程式正确的是( )
| A、金属铝和过量的氢氧化钠溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| C、稀硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |