题目内容
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述错误的是( )
| A、原子半径的大小顺序:Y>Z>W>X |
| B、元素W的最高价氧化物对应水化物的酸性比Z的强 |
| C、元素X的两种氢化物中,常温常压下均为液态,有一种含氢键,另一种没有氢键 |
| D、化合物YX、ZX2的化学键类型不相同 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,据此解答.
解答:
解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Mg>Si>S>O,即Y>Z>W>X,故A正确;
B.非金属Si<S,故元素S的最高价氧化物对应水化物的酸性比Si的强,故B正确;
C.元素X的两种氢化物为水、双氧水,常温常压下均为液态,均含有氢键,故C错误;
D.化合物MgO为离子化合物,含有离子键,SiO2属于共价化合物,含有共价键,故D正确;
故选:C.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Mg>Si>S>O,即Y>Z>W>X,故A正确;
B.非金属Si<S,故元素S的最高价氧化物对应水化物的酸性比Si的强,故B正确;
C.元素X的两种氢化物为水、双氧水,常温常压下均为液态,均含有氢键,故C错误;
D.化合物MgO为离子化合物,含有离子键,SiO2属于共价化合物,含有共价键,故D正确;
故选:C.
点评:本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列判断不正确的是( )
①若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB;
②FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体;
③CH3COONa水解产生CH3COOH和OH-,向水解液中加入少量冰醋酸会因其中和OH-而使水解平衡右移;
④因Fe3++3H2O?Fe(OH)3+3H+,为抑制水解,配制FeCl3溶液时需将FeCl3溶解在稀H2SO4中;
⑤中和pH和体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同.
①若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB;
②FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体;
③CH3COONa水解产生CH3COOH和OH-,向水解液中加入少量冰醋酸会因其中和OH-而使水解平衡右移;
④因Fe3++3H2O?Fe(OH)3+3H+,为抑制水解,配制FeCl3溶液时需将FeCl3溶解在稀H2SO4中;
⑤中和pH和体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同.
| A、只有①②④⑤ | B、只有②③⑤ |
| C、只有①②③⑤ | D、全部 |
如图是用500mL容量瓶配制0.10mol?L-1 NaOH溶液的过程.错误步骤有( )


| A、1处 | B、2处 | C、3处 | D、4处 |
根据如图,下列判断中正确的是( )
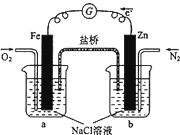

| A、烧杯a中发生反应O2+4H++4e═ˉ2H2O,溶液pH降低 |
| B、烧杯b中发生反应为2Zn-4eˉ═2Zn2+ |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
下列各组物质的最简式相同的是( )
| A、乙酸和乙二酸 |
| B、丁酸和乙酸 |
| C、甲醛和乙酸 |
| D、乙二酸和乙二醇 |
下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
①稀H2SO4和Na2CO3 ②KOH和Al2(SO4)3 ③Ca(OH)2和NaHCO3 ④NaAlO2和稀盐酸.
①稀H2SO4和Na2CO3 ②KOH和Al2(SO4)3 ③Ca(OH)2和NaHCO3 ④NaAlO2和稀盐酸.
| A、①②④ | B、①②③ |
| C、①③④ | D、全部 |
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,不正确的是( )


| A、A分子属于酯类化合物,在一定条件下能发生水解反应 |
| B、符合题中A分子结构特征的有机物有2种 |
| C、A在一定条件下可与3mol H2发生加成反应 |
| D、分子式为C8H8O2且分子中含苯环和一COOR(-R为烃基)的物质共有6种 |
下列定量仪器读数正确的是( )
A、 8.0mL |
B、 24.00g |
C、 23.65mL |
D、 38.2℃ |