题目内容
6.设NA表示阿伏加德罗常数.下列说法中错误的是( )| A. | 0.1mol/L的NaClO溶液中含ClO-的浓度小于0.1mol/L | |
| B. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| C. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| D. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
分析 A、次氯酸根为弱酸根,在溶液中水水解;
B、求出乙烯的物质的量,然后根据1mol乙烯中含4mol极性共价键来分析;
C、氢氧根中含10个电子,而羟基中含9个电子;
D、甲醛和甲酸甲酯的最简式均为CH2O.
解答 解:A、次氯酸根为弱酸根,在溶液中水水解;,故ClO-的浓度小于0.1mol/L,故A正确;
B、标况下22.4L乙烯的物质的量为1mol,而1mol乙烯中含4mol极性共价键,故含4NA条,故B正确;
C、氢氧根中含10个电子,而羟基中含9个电子,故1mol氢氧根中含10NA个电子,而1mol羟基中含9NA个电子,故C错误;
D、甲醛和甲酸甲酯的最简式均为CH2O,故3.0g混合物中含有CH2O的物质的量为0.1mol,则含0.4NA个原子,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
16.Na、Al、Fe都是重要的金属元素.下列说法正确的是( )
| A. | 三者的氧化物都是碱性氧化物 | |
| B. | 三者的氢氧化物都是白色固体 | |
| C. | 三者的氯化物都可用化合反应制得 | |
| D. | 三者的单质在空气中最终都生成氧化物 |
17.从植物黄花蒿茎叶中提取的青蒿素,其结构简式如图,下列说法正确的是( )


| A. | 青蒿素不能与NaOH溶液发生反应 | |
| B. | 它的分子式为C15H24O5 | |
| C. | 因其具有过氧基团,它不稳定,易受温度和还原性物质的影响而变质 | |
| D. | 它在常见有机溶剂中的溶解度小于在水中的溶解度 |
14.向一定量的Fe、FeO、Fe2O3的混合物中,加入50mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下112mL气体.向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为( )
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 1.4g |
1.PX是纺织工业的基础原料,其结构简式为 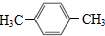 ,下列关于PX的说法正确的是( )
,下列关于PX的说法正确的是( )
 ,下列关于PX的说法正确的是( )
,下列关于PX的说法正确的是( )| A. | 属于饱和烃 | B. | 其一氯代物有四种 | ||
| C. | 可用于生产对苯二甲酸 | D. | 分子中所有原子都处于同一平面 |
11.下列说法正确的是( )
| A. | 工业上用FeCl3溶液吸收废气中的H2S气体,离子方程式为:Fe3++H2S=Fe2++S↓+2H+ | |
| B. | 在0.1 mol/L的AlCl3溶液中,Na+、K+、SO42-、HCO3-均可大量共存 | |
| C. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| D. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) |
18. 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )| A. | a点时溶液的pH<1 | |
| B. | c点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42-) | |
| D. | a点到b点的过程中,溶液的导电能力增强 |
15.在一定条件下,反应2A(g)+B(g)?2C(g)在一密闭容器中达到平衡.充入适量B气体并维持B浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时A的转化率将( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
3.已知自然界的氧原子有3种:16O、17O、18O,氢原子有1H、2H,从水分子的原子构成来看,自然界的水共有( )
| A. | 2种 | B. | 6种 | C. | 9种 | D. | 12种 |