题目内容
11.下列说法正确的是( )| A. | 工业上用FeCl3溶液吸收废气中的H2S气体,离子方程式为:Fe3++H2S=Fe2++S↓+2H+ | |
| B. | 在0.1 mol/L的AlCl3溶液中,Na+、K+、SO42-、HCO3-均可大量共存 | |
| C. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| D. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) |
分析 A.发生氧化还原反应生成,电子、电荷不守恒;
B.离子之间相互促进水解;
C.pH=4的NaHC2O4溶液,显酸性,可知电离大于水解;
D.25℃时NH4CN溶液显碱性,则水解大于电离.
解答 解:A.工业上用FeCl3溶液吸收废气中的H2S气体,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故A错误;
B.Al3+、HCO3-相互促进水解,不能大量共存,故B错误;
C.pH=4的NaHC2O4溶液,显酸性,可知电离大于水解,则c(H2C2O4)<c(C2O42-),故C错误;
D.25℃时NH4CN溶液显碱性,则水解大于电离,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN),故D正确;
故选D.
点评 本题考查较综合,涉及离子反应、离子共存及离子浓度比较等,为高频考点,把握发生的反应、电离与水解的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
1.如图所示,将铁钉放入纯水中,一段时间后,铁钉表面有铁锈生成,下列说法正确的是( )
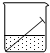

| A. | 铁钉与水面交接处最易腐蚀 | |
| B. | 铁钉发生吸氧腐蚀,铁做阴极 | |
| C. | 铁发生的反应是:Fe-3e→Fe3+ | |
| D. | 水上和水下部分的铁钉不发生电化腐蚀 |
2.某有机化合物M的结构简式为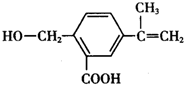 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )
 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )| A. | 有机物M的分子式为C11H14O3 | |
| B. | 1 molNa2CO3最多能消耗1 mol有机物M | |
| C. | 有机物M能发生取代、氧化、还原和加聚反应 | |
| D. | 有机物M能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
6.设NA表示阿伏加德罗常数.下列说法中错误的是( )
| A. | 0.1mol/L的NaClO溶液中含ClO-的浓度小于0.1mol/L | |
| B. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| C. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| D. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 1 L浓度为1 mol•L-1的 H2O2水溶液中含有的氧原子数为2NA | |
| D. | MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA |
20.NA表示阿伏加德罗常数.下列叙述正确的是( )
| A. | 通常状况下,1mol/L Na2CO3溶液中含钠离子数为2NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1mol N5+含有的电子数为34NA | |
| D. | 1mol NH4+中含有的中子数为10NA |
 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答: