题目内容
10.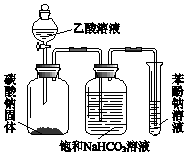 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.(1)苯酚钠溶液中发生反应的化学方程式是C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
(2)饱和NaHCO3溶液的作用是除去二氧化碳中混有的乙酸.
(3)苯酚、乙酸、碳酸的酸性由强到弱的顺序是乙酸>碳酸>苯酚.
分析 比较苯酚、乙酸、碳酸的酸性,由实验装置可知,乙酸与碳酸钠发生CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O,饱和碳酸氢钠溶液除去挥发的乙酸,小试管中发生C6H5O-+CO2+H2O→C6H5OH+HCO3-,均为强酸制取弱酸的反应,可比较酸性,以此来解答.
解答 解:(1)苯酚钠溶液中发生反应的化学方程式是C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(2)饱和NaHCO3溶液的作用是除去二氧化碳中混有的乙酸,故答案为:除去二氧化碳中混有的乙酸;
(3)由CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O、C6H5O-+CO2+H2O→C6H5OH+HCO3-可知,均为强酸制取弱酸的反应,则苯酚、乙酸、碳酸的酸性由强到弱的顺序是乙酸>碳酸>苯酚,故答案为:乙酸>碳酸>苯酚.
点评 本题考查有机物酸性的比较,为高频考点,把握强酸制取弱酸的反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意乙酸易挥发,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
20.在一定条件下的恒容容器发生可逆反应:2A(g)+2B(g)?3C(g)+D(g),反应达化学平衡的标志是( )
| A. | 单位时间内生成n mol A,同时生成n mol D | |
| B. | B的浓度保持不变 | |
| C. | 容器内混合气体的密度不随时间而变化 | |
| D. | 单位时间内消耗n mol B,同时消耗n mol A |
1.下列分子或离子中,不存在sp3杂化类型的是( )
| A. | SO42- | B. | NH3 | C. | C2H6 | D. | SO2 |
5.下列方法常用于分析有机物的相对分子质量的是( )
| A. | 红外光谱法 | B. | 核磁共振氢谱法 | C. | 质谱法 | D. | 燃烧法 |
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中含有的HCO3-数目为0.1NA | |
| C. | 1LpH=1的硫酸溶液中含有的H+数为0.2NA | |
| D. | 标准状况下,2.24LCO和CO2混合气体中含有的氧原子数为0.15NA |
3.下列化学反应的离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | Cl2通入FeCl2溶液中:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 少量CO2通入澄清石灰水中:CO2+2OH-+Ca2+═Ca CO3↓+H2O | |
| D. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
20.下列常见材料中,属于有机高分子材料的是( )
| A. | 塑料 | B. | 陶瓷 | C. | 玻璃 | D. | 水泥 |
1.下列有关化学用语书写正确的是( )
| A. | 碳酸氢钠的水解:HCO3-+H2O=H3+O+CO32- | |
| B. | 14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3O2(g)═2H2O(g)+2CO2(g)△H=-2b kJ•mol-1 | |
| C. | 用两根铜棒电解盐酸:2H++2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | 在酸性碘化亚铁溶液中通入少量氧气:4I-+O2+4H+=2I2+2H2O |
