题目内容
18.某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
(1)滤渣A中主要含有硅、铜;操作①使用的玻璃仪器有漏斗、烧杯、玻璃棒
(2)写出向滤液A中通入Cl2所发生生反应的离子方程式:2 Fe2++Cl2=2Fe3++2Cl-,写出加入过量NaOH溶液所发生反应的离子方程式Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O.
(3)实验室进行步骤④用到的仪器有坩埚钳、酒精灯、三脚架、坩埚和泥三角
(4)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为$\frac{7b}{10a}$×100%(用含a、b的式子表示)
(5)有同学用以上试剂设计了另一方案,也达到了同样的目的,依次加入的试剂是:加入足量 NaOH溶液;加入足量盐酸,通足量氯气; 加入足量 NaOH溶液;加热灼烧得Fe2O3固体.
分析 不锈钢(主要成分为Fe)样品中含有铝、铜、硅等,加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铜溶液,铜不溶解,过滤得到滤渣A为铜和硅,滤液A中含有的溶质成分为FeCl2、AlCl3,通过氯气把氯化亚铁氧化为氯化铁得到溶液B中为FeCl3、AlCl3,B溶液中加入过量氢氧化钠溶液过滤,得到红褐色氢氧化铁沉淀和滤液C,滤液C中含有的溶质NaAlO2、NaCl、NaOH,红褐色沉淀氢氧化铁加热分解得到氧化铁,
(1)加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铝溶液,铜、硅不溶解,过滤得到滤渣A为铜、硅,滤液A中含有的溶质成分为FeCl2、AlCl3;溶解后通过操作①分离的溶液和滤渣,操作的名称是过滤,依据操作选择仪器;
(2)滤液A中是FeCl2、AlCl3,向滤液A中通入Cl2所发生生反应是氯气氧化亚铁离子为铁离子,加入过量氢氧化钠溶液得到红褐色沉淀氢氧化铁和溶液偏铝酸钠溶液,溶液B生成红褐色沉淀B为氢氧化铁沉淀;
(3)实验室进行步骤④是灼烧固体,在坩埚中进行,据此选择仪器;
(4)样品质量为ag,所得Fe2O3固体称量得质量为b g,依据铁元素守恒计算该样品中铁元素质量分数;
(5)不锈钢(主要成分为Fe)样品中含有铝、铜、硅等,先加入氢氧化钠溶液,铝和硅溶解,铁和铜不反应,过滤得到滤液为硅酸钠和偏铝酸钠溶液,固体为铁和铜,加入足量盐酸溶解过滤得到氯化亚铁溶液,通入足量氯气氧化亚铁离子得到铁离子,加入足量 NaOH溶液;加热灼烧得Fe2O3固体;
解答 解:不锈钢(主要成分为Fe)样品中含有铝、铜、硅等,加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铝溶液,铜、硅不溶解,过滤得到滤渣A为铜、硅,滤液A中含有的溶质成分为FeCl2、AlCl3,通过氯气把氯化亚铁氧化为氯化铁,2FeCl2+Cl2=2FeCl3,得到溶液B中为FeCl3、AlCl3,B溶液中加入过量氢氧化钠溶液反应为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,AlCl3+4NaOH=NaAlO2+3NaCl,过滤得到红褐色氢氧化铁沉淀和滤液C,滤液C中含有的溶质NaAlO2、NaCl、NaOH,红褐色沉淀氢氧化铁加热分解得到氧化铁,
(1)加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铝溶液,铜不溶解,过滤得到滤渣A为铜,滤液A中含有的溶质成分为FeCl2、AlCl3;因素溶解后通过操作①分离的溶液和滤渣,操作的名称是过滤,需要用到的玻璃仪器为:漏斗、玻璃棒、烧杯,
故答案为:硅、铜;漏斗、玻璃棒、烧杯;
(2))滤液A中是FeCl2、AlCl3,向滤液A中通入Cl2所发生生反应是氯气氧化亚铁离子为铁离子,反应的离子方程式为:2 Fe2++Cl2=2Fe3++2Cl-,加入过量氢氧化钠溶液得到红褐色沉淀氢氧化铁和溶液偏铝酸钠溶液,溶液B生成红褐色沉淀B的离子方程式为Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O,
故答案为:2 Fe2++Cl2=2Fe3++2Cl-;Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O;
(3)实验室进行步骤④用到的仪器有坩埚钳、酒精灯、三脚架、坩埚、泥三角,
故答案为:坩埚、泥三角;
(4)品质量为ag,所得Fe2O3固体称量得质量为b g,依据铁元素守恒计算该样品中铁元素质量分数=$\frac{\frac{bg}{160g/mol}×2×56g/mol}{ag}$×100%=$\frac{7b}{10a}$×100%,
故答案为:$\frac{7b}{10a}$×100%;
(5)不锈钢(主要成分为Fe)样品中含有铝、铜、硅等,先加入氢氧化钠溶液,铝和硅溶解,铁和铜不反应,过滤得到滤液为硅酸钠和偏铝酸钠溶液,固体为铁和铜,加入足量盐酸溶解过滤得到氯化亚铁溶液,通入足量氯气氧化亚铁离子得到铁离子,加入足量 NaOH溶液;加热灼烧得Fe2O3固体,
故答案为:加入足量盐酸,通足量氯气;
点评 本题考查了物质成分的实验测定和实验探究方法,流程分析判断溶液和沉淀的成分分析判断是解题关键,题目难度中等.

| A. | 混合物 | B. | 纯净物 | C. | 酸 | D. | 碱 |

| A. | 200℃时,反应从开始到平衡的平均速率 v(A)=0.08 mol•L-1•min-1 | |
| B. | 若 0~5 min 时容器与外界的热交换总量为 m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| C. | 200℃时,若在第 6 min 再向体系中加入催化剂,可使 v 正>v 逆 | |
| D. | 200℃时,平衡后再充入 2 mol C,则达到平衡时,化学平衡常数变小 |
| A. | 实验证实,不存在两种邻二甲苯,所以现代物质结构理论认为苯分子中碳碳键完全相同,而不是单双键交替结构 | |
| B. | 两种有机物若具有相同的摩尔质量,不同的结构,则一定是互为同分异构体 | |
| C. | 醛能发生银镜反应,但发生银镜反应的有机物不一定是醛类 | |
| D. | 等质量的两种有机物完全燃烧生成等质量的水,则两有机物中氢元素的质量分数必须是相等 |
| A. | 称取7.68g CuSO4,加入480mL水 | B. | 称取12.0g胆矾配成500 mL溶液 | ||
| C. | 称取8.0g CuSO4,加入500 mL水 | D. | 称取12.5g胆矾配成500 mL溶液 |
| A. | 甲烷 | B. | 苯 | C. | 环己烷 | D. | 甲苯 |
| A. | 需要加热才能发生的化学反应叫吸热反应 | |
| B. | 化学反应必然伴随能量变化,没有能量变化的化学反应是不存在的 | |
| C. | 化学反应的能量来自物质状态变化所产生的能量 | |
| D. | 断裂化学键要放热,形成化学键要吸热 |
| A. | 严格控制硝酸厂的尾气处理 | |
| B. | 倡导使用无磷洗衣粉 | |
| C. | 研究新型催化剂,消除汽车尾气污染 | |
| D. | 禁止使用含氟电冰箱 |
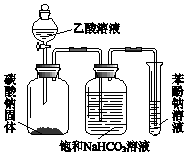 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.