题目内容
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中含有的HCO3-数目为0.1NA | |
| C. | 1LpH=1的硫酸溶液中含有的H+数为0.2NA | |
| D. | 标准状况下,2.24LCO和CO2混合气体中含有的氧原子数为0.15NA |
分析 A、求出甲烷的物质的量,然后根据甲烷中含10个电子来分析;
B、HCO3-在溶液中既能电离又能水解;
C、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L;
D、求出混合气体的物质的量,然后根据CO和二氧化碳中分别含1个氧原子和2个氧原子来分析.
解答 解:A、1.6g甲烷的物质的量为0.1mol,而甲烷中含10个电子,故0.1mol甲烷中含NA个电子,故A正确;
B、HCO3-在溶液中既能电离又能水解,故溶液中HCO3-的个数小于0.1NA个,故B错误;
C、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L,故1L溶液中氢离子的物质的量n=CV=0.1mol/L×1L=0.1mol,故个数为0.1NA个,故C错误;
D、标况下2.24L混合气体的物质的量为0.1mol,而CO和二氧化碳中分别含1个氧原子和2个氧原子,故0.1mol混合气体中含有的氧原子个数介于0.1NA到0.2NA之间,但不一定是0.15NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
6.下列关于有机物的叙述中不正确的是( )
| A. | 实验证实,不存在两种邻二甲苯,所以现代物质结构理论认为苯分子中碳碳键完全相同,而不是单双键交替结构 | |
| B. | 两种有机物若具有相同的摩尔质量,不同的结构,则一定是互为同分异构体 | |
| C. | 醛能发生银镜反应,但发生银镜反应的有机物不一定是醛类 | |
| D. | 等质量的两种有机物完全燃烧生成等质量的水,则两有机物中氢元素的质量分数必须是相等 |
3.下列物质能使酸性高锰酸钾溶液褪色的是( )
| A. | 甲烷 | B. | 苯 | C. | 环己烷 | D. | 甲苯 |
1.绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染.绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染.下列化学反应,不符合绿色化学概念的是( )
| A. | 消除硫酸厂尾气排放 SO2+NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染 NO2+NO+NaOH═2NaNO2+H2O | |
| C. | 制CuSO4Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4 2Cu+O2═2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
8.有关化学反应的说法正确的是( )
| A. | 需要加热才能发生的化学反应叫吸热反应 | |
| B. | 化学反应必然伴随能量变化,没有能量变化的化学反应是不存在的 | |
| C. | 化学反应的能量来自物质状态变化所产生的能量 | |
| D. | 断裂化学键要放热,形成化学键要吸热 |
5.下列反应的离子方程式中,书写正确的是( )
| A. | 往溴化亚铁溶液中加入足量氯水2Fe2++Cl2═2 Fe3++2Cl- | |
| B. | 铝与氢氧化钠溶液反应Al+4OH-═[Al(OH)4]- | |
| C. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 往氯化铝溶液中加入氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ |
6. 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极,发生氧化反应 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 | |
| D. | 充电时转移2mol电子,阴极质量减少32g |


 .
. .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件): .
.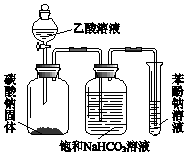 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.