题目内容
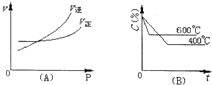 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |
考点:体积百分含量随温度、压强变化曲线,化学反应速率与化学平衡图象的综合应用
专题:
分析:由图Ⅰ可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图Ⅱ可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应,据此结合选项解答.
解答:
解:A、N2O3(g)?NO2(g)+NO(g)△H>0,正反应是气体物质的量增大的反应,但正反应是吸热反应,不符合反应特征,故A不选;
B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,故B选;
C、3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,反应前后气体物质的量不变,正反应是放热反应,不符合反应特征,故C不选;
D、CO2(g)+C(s)?2CO(g)△H>0,正反应是气体物质的量增大的反应,正反应是吸热反应,不符合反应特征,故D不选;
故选B.
B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,故B选;
C、3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,反应前后气体物质的量不变,正反应是放热反应,不符合反应特征,故C不选;
D、CO2(g)+C(s)?2CO(g)△H>0,正反应是气体物质的量增大的反应,正反应是吸热反应,不符合反应特征,故D不选;
故选B.
点评:本题考查化学平衡移动图象,难度中等,把握图象中曲线的变化特点分析可逆反应的特征是解答该题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
实验室保存下列药品的方法不正确的是( )
| A、氢氟酸保存在密封的玻璃瓶中 |
| B、少量金属钠保存在煤油中 |
| C、硅酸钠保存在带橡皮塞的试剂瓶中 |
| D、氢氧化钠溶液保存在带橡皮塞的试剂瓶中 |
不能证明HCN是弱电解质的是( )
| A、1mol.L-1氢氯酸(HCN)的pH约为3 |
| B、常温下,pH=4的氢氯酸稀释100倍后所得溶液pH<6 |
| C、10mL 1 mol.L-1氢氯酸(HCN)恰好与10mL 1 mol.L-1NaOH溶液完全反应 |
| D、常温下,0.1mol.L-1NaCN溶液的pH约为10 |
已知:C(s)+CO2(g)═2CO(g)△H>0,该反应达到平衡后,改变下列条件都有利于反应向正方向进行的是( )
| A、升高温度和减小压强 |
| B、降低温度和减小压强 |
| C、降低温度和增大压强 |
| D、升高温度和增大压强 |
下列说法正确的是( )
| A、凡有杂质的铜片放在稀硫酸中,较长时间后发现溶液变蓝色,说明Cu片发生了吸氧腐蚀 |
| B、反应H2S+H2SO4(浓)═S↓+SO2↑+2H2O中,生成物S是还原产物. |
| C、元素的非金属性强弱与其氢化物水溶液的酸性强弱相一致 |
| D、已知:P4(s)+6Cl2═4PCl3(g)△H=a KJ?mol-1 P4(s)+10Cl2(g)=4PCl5(g)△H=bKJ?mol-1 由此可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H |
下列有关化学反应速率的说法中,正确的是( )
| A、100mL2mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制氢气时,改用铁片和浓硫酸反应可增大反应物浓度,所以可以加快产生氢气的速率 |
| C、二氧化硫的催化氧化是一个放热反应,升高温度,反应活化能降低,反应速率加快 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,活化分子百分数不变,反应速率减小 |
 洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体:
洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体: +CH2=CH-R
+CH2=CH-R  +HX属于相同反应类型的是( )
+HX属于相同反应类型的是( )


